Caenorhabditis elegans – động vật mô hình trong nghiên cứu Sinh học phân tử
Từ khóa: Caenorhabditis elegans; Chức năng của gen; GFP; RNAi; Chuyển gen
Abstract
To explore the biological principles, biologists have been using different model organisms such as E. coli, yeast, Drosophila, mice, human cells, Arabidopsis, maize and so on. Since none of them is perfect and appropriate for various types of research, biologists have to select suitable models for their specific reseearch focuses. This paper introduces Caenorhabditis elegans (C. elegans), a tiny round-worm species, as an organismal model, and its fundamentally biological characters. Since the first genetics studies by Sydney Brenner in 1963, C. elegans has become commonly used for research on functional genetics, cell and developmental biology, evolution and bio-medication. This paper reports four biological breakthroughs from C. elegans, including apoptosis, green fluorescence protein, RNA interference and aging. Additionally, we also present our research on Caenorhabditis biodiversity and the effects of females on males' behaviors using C. elegan.
Tóm tắt
Để hiểu được nhiều quy luật sống của sinh vật, con người đã sử dụng nhiều mô hình khác nhau như E. coli, nấm men, ruồi dấm, chuột, tế bào người, Arabidopsis, ngô, v.v.. Vì không có một mô hình nào lý tưởng và phù hợp với các dạng nghiên cứu khác nhau nên nhà sinh vật học cần chọn mô hình phù hợp với từng mục tiêu nghiên cứu chuyên biệt. Bài báo này giới thiệu Caenorhabditis elegans - một loài giun tròn nhỏ, và những đặc điểm căn bản của nó. Kể từ những nghiên cứu di truyền học đầu tiên của Sydney Brenner năm 1963, giun C. elegans đã được sử dụng rất nhiều trong các nghiên cứu di truyền chức năng, tế bào, sinh học phát triển, tiến hóa sinh học và y sinh. Bài báo trích dẫn bốn khám phá sinh học bắt nguồn từ C. elegans bao gồm: cơ chế tự huỷ diệt của tế bào (apoptosis), kìm hãm biểu hiện gen bằng cách phân hủy RNA (RNAi), protein phát huỳnh quang (GFP) và sự lão hóa. Những nghiên cứu của nhóm chúng tôi, ứng dụng C. elegans trong nghiên cứu đa dạng sinh học các loài thuộc chi Caenorhabditis và ảnh hưởng của giới cái lên các hành vi của giới đực, cũng sẽ được trình bày trong bài.
Lịch sử
Caenorhabditis elegans là loài giun tròn sống tự do trong môi trường đất với kích thước trưởng thành khoảng 1 mm. Năm 1963, Sydney Brenner bắt đầu ý tưởng nghiên cứu tính chất di truyền của sự phát triển ở tế bào thần kinh trong C. elegans. Năm 1974, Brenner nghiên cứu sinh học phân tử và sinh học phát triển của C. elegans và kể từ đó C. elegans được sử dụng rộng rãi trong nghiên cứu sinh học (1).
Sự phát triển và tập tính của giun Caenorhabditis elegans
Cơ thể giun C. elegans dài khoảng 1 mm ở độ tuổi trưởng thành. Phần chính cơ thể cấu tạo dạng “hai ống” lồng vào nhau: trong cùng là ống ruột, ngoài cùng là lớp biểu bì cu-tin và hệ thống cơ. Cơ thể được chia thành ba phần: đầu, thân và đuôi. Trong quần thể có con lưỡng tính và con đực. Thông thường con lưỡng tính chiếm áp đảo và con đực chiếm khoảng 0.2%. Con lưỡng tính được cấu tạo bởi 959 tế bào (2) và con đực là 1003 (3). Cơ thể gồm có hệ thống tế bào soma, tế bào sinh sản và tế bào thần kinh. Dưới kính hiển vi chúng ta có thể nhìn xuyên thấu vào các cơ quan bên trong cơ thể giun (Hình 1).

Hình 1: Cấu trúc cơ thể giun lưỡng tính và giun đực C. elegans.1-phần đầu;2-cơ quan sinh dục; 3-ruột; 4-đuôi; 5-hợp tử hoặc phôi; 6-âm hộ; 7-cơ quan tạo hoặc lưu trữ tinh trùng; 8-trứng; 9-gai giao hợp. 1-phần đầu; 2-cơ quan sinh dục; 3-ruột; 4-đuôi; 5-hợp tử hoặc phôi; 6-âm hộ; 7-cơ quan tạo hoặc lưu trữ tinh trùng; 8-trứng; 9-gai giao hợp.
Giun C. elegans sống khoảng 20 ngày. Giun phát triển qua bốn giai đoạn ấu trùng (ấu trùng L1, L2, L3, L4), trưởng thành, sinh sản, lão hóa, và chết. Giun có thể chuyển sang trạng thái sống tiềm sinh trong vài tháng ở giai đoạn L2 khi thiếu thức ăn, mật độ cá thể đông và nhiệt độ thấp (Hình 2).
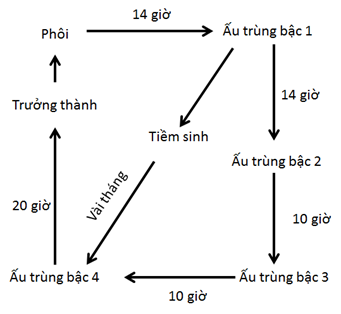
Hình 2: Vòng đời và phát triển của giun C. elegans ở nhiệt nhiệt độ 20 oC.
C. elegans có chu kỳ phát triển là ba ngày, thông thường bắt đầu sinh sản từ ngày thứ 3 cho tới ngày thứ 5 kể từ khi sinh ra. Vì có con lưỡng tính nên sinh sản tự phối sản xuất khoảng 300 cá thể. Vì có cả con đực nên sinh sản giao phối giữa con đực và con lưỡng tính sản xuất vài trăm cho tới khoảng 1000 con lai.
Hệ gen và gen
Kích thước hệ gen là 100.272.276 Mb và phân bố thành năm cặp nhiễm sắc thể: bốn cặp nhiễm sắc thể thường và một nhiễm sắc thể giới tính X. Tất cả các nhiễm sắc thể đều có cấu trúc holocentric (các nhiễm sắc thể không phân định rõ tâm động), trong đó con lưỡng tính có cặp nhiễm sắcc thể giới tính là XX và con đực là XO. Hệ gen của C. elegans có những đặc trưng chung của sinh vật cấu tạo bởi tế bào nhân chuẩn bao gồm khoảng 19.000 gen (3), trình tự nucleotit lặp, yếu tố nhảy (gen nhảy) v.v.. Khoảng 60-80% gen giun giống với gen người (4). Toàn bộ hệ gen đã được giải trình tự trên dòng giun đồng hợp tử C. elegans N2. Cùng với những ưu thế tiện lợi khác, C. elegans được sử dụng rộng rãi trong nhiều nghiên cứu sinh học liên quan tới các locus.
Tiện ích trong thí nghiệm nghiên cứu gen
Hiện nay cộng đồng các nhà khoa học sử dụng giun C. elegans đã rất đông trên thế giới, vì vậy các thông tin liên quan tới một nghiên cứu thường có nhiều sự tham khảo. Mọi thông tin thường xuyên cập nhật tại địa chỉ www.WormBase.org. Các thư viện như RNAi (RNA interference) và thư viện biểu hiện ORF (open reading frame expression library - là tập hợp các dòng vi khuẩn mang cDNA tái tổ hợp) đã được tạo ra cho hầu hết các gen. Sự phát triển và biệt hoá của các cơ quan và từng tế bào đã được mô tả chi tiết. Kỹ thuật RNAi và vi tiêm gen không phức tạp và đã được ứng dụng rộng rãi trên thế giới. Hai kỹ thuật này vô cùng cần thiết trong nghiên cứu chức năng trực tiếp của gen. Khi biết trình tự nucleotit và vị trí của gen, đột biến gen có chủ đích được thực hiện bằng cách sử dụng ethyl methanesulfonate (EMS), tia UV và transposon (5). Mới đây phương pháp đột biến gen CRISPR/Cas9 đã được ứng dụng và quy trình hóa để gây đột biến gen quan tâm trong C. elegans. Phương pháp này được tóm tắt như sau: một phức hợp vector mã hóa CRISPR/Cas9 cho gen quan tâm được tạo ra và vi tiêm vào giun mẹ lưỡng tính; hệ vector được kích hoạt bởi enzyme phiên mã và giải mã và gây đột biến gen chủ đích trong tế bào sinh dục của giun mẹ; những tế bào sinh dục mang gen đột biến phát triển thành các giao tử (trứng và tinh trùng) và thụ tinh cho nhau tạo ra các hợp tử mang gen đột biến mất hoặc thêm nucleotit (6, 7). Vì vòng đời ngắn, lai chéo giữa các dòng giun không khó và con lai có số lượng đông, C. elegans được sử dụng để xác định tương tác di truyền giữa hai gen bằng cách lai hai đột biến của hai gen quan tâm cùng quy định một tính trạng.
Những phát hiện tiêu biểu từ Caenorhabditis elegans
Tương tự nhiều sinh vật mô hình khác như nấm men, cây Arabidopsis, ruồi dấm, chuột và tế bào người, giun C. elegans đã được sử dụng nhiều trong nghiên cứu sinh học phân tử và đã góp phần tìm ra nhiều tính chất của sự sống.
Năm 2002, giải Nobel Y hoc được trao cho các tác giả đã phát hiện cơ chế tự hủy diệt tế bào (apoptosis) trên C. elegans (8). Apoptosis là một hiện tượng "chết chủ động do chương trình di truyền điều khiển" của tế bào. Tế bào thực hiện apoptosis thể hiện các đặc điểm cơ bản như DNA nhân bị phân hủy, màng ty thể mất điện thế và màng tế bào tách khỏi tế bào chất. Trong quá trình phát triển phôi thai giun C. elegans lưỡng tính 1090 tế bào được sinh ra và 131 tế bào tự hủy diệt. Người ta đã tìm ra khoảng 20 gen liên quan điều hòa quá trình tự hủy diệt, trong số đó, bốn gen vô cùng cần thiết là ced-3 (CEll Death abnormality), ced-4, ced-9 và egl-1 (EGg Laying defective). Các gen này taọ ra các protein tương ứng và cùng hoạt động trong tế bào được xác định tự hủy diệt. CED-3, CED-4 và EGL-1 là các protein kích hoạt apoptosis và CED-9 là protein chống lại apoptosis của 131 tế bào.
Protein phát huỳnh quang xanh (green fluorescent protein - GFP) được sử dụng làm dấu hiệu biểu hiện gen và vị trí protein trong tế bào (được trao giải Nobel Hóa học năm 2008) (9, 10) (Hình 3).
Gen GFP đầu tiên được phân lập từ loài sứa biển (Aequorea victoria). Protein GFP có 238 amino acid, hấp thụ sóng UV tối ưu ở bước sóng 450 nm tới 490 nm và phát ra huỳnh quang xanh. Tính chất này được ứng dụng để theo dõi biểu hiện một gen bất kỳ (tạm gọi là A) và protein mã hóa bởi gen đó (protein A) trong tế bào sống của giun. Gen A được thao tác gen để gắn gen GFP và tạo ra một vector tái tổ hợp A::GFP hoặc GFP::A. Khi được vi tiêm vào giun, vector biểu hiện protein tái tổ hợp phát huỳnh quang xanh. Gen đầu tiên được áp dụng nghiên cứu biểu hiện là mec-7 mã hóa protein β-tubulin.

Hình 3: GFP biểu hiện trong tế bào. 1-tế bào uste; 2-tế bào ruột
Nghiên cứu hạn chế biểu hiện gen ở mức độ RNA (RNA interference, gọi tắt RNAi) được trao giải Nobel Sinh-Y học năm 2006 cũng là một nghiên cứu sử dụng C. elegans (11, 12). Kỹ thuật RNAi sử dụng siRNA, phân tử RNA ở trạng thái mạch kép bổ trợ, có độ dài khoảng 20 nucleotit, được tạo ra từ dsRNA (double strand RNA) bởi phức hợp protein Dicer. siRNA cùng với một số protein khác như PIWI tạo ra phức hợp RISC (RNA Inducing Silencing Complex). Phức hợp RISC bám vào pre-mRNA và/hoặc mRNA của gen mục tiêu tại vị trí mà phân tử siRNA mạch đơn bám vào theo nguyên tắc bổ trợ. Phức hợp RISC cắt các phân tử mRNA mục tiêu, kết quả là tế bào thiếu mRNA để tổng hợp đủ lượng phân tử protein mục tiêu (13). Những gen đầu tiên của C. elegans thành công với hiện tượng RNAi là unc-22 (UNCoordinatee), fem-1 (FEMinization of XX và XO animals), unc-54, hlh-1 (Helix Loop Helix) và gen ngoại lai GFP có nguồn gốc từ sứa được vi tiêm vào C. elegans (11).
Gen tham gia vào quá trình lão hóa đã được phát hiện trên C. elegans. Trong một nghiên cứu di truyền tuổi thọ, Kenyon đã sử dụng kỹ thuật RNAi để ức chế biểu hiện gen của gen daf-2 (abnormal DAuer Formation), dẫn đến kéo dài tuổi thọ của giun. Thêm vào đó, đột biến mất nucleotit dẫn đến mất chức năng của gen daf-2 cũng kéo dài tuổi thọ của giun, cho phép giun sống lâu gấp ba lần so với bình thường (14). Các thí nghiệm trên chứng tỏ gen daf-2 hạn chế tuổi thọ giun. Ngược lại đột biến mất chức năng của gen daf-16 gây rút ngắn tuổi thọ, chứng tỏ daf-16 có chức năng duy trì tuổi thọ giun (2). Cả hai gen này đều có các gen đồng dạng ở người liên quan đến con đường đồng hóa đường liên quan đến insulin. Phát hiện này mở ra một ý tưởng là con người có thể kéo dài tuổi thọ nhờ thay đổi di truyền.
Ngoài vai trò mấu chốt trong các phát hiện mang tính đột phá kể trên, các loài giun thuộc giống Caenorhabditis cũng được sử dụng trong nghiên cứu tiến hóa sinh vật (như nghiên cứu hệ gen) (15, 16); trong Sinh-Y (như nghiên cứu bệnh Alzaimer và đái tháo đường (4, 17).
Có khả năng sử dụng C. elegans ở Việt Nam?
Tôi cho rằng C. elegans là động vật mô hình nghiên cứu có thể dùng trong nghiên cứu sinh học ở mức độ quần thể, nhóm cá thể, cá thể, cơ quan, tế bào và phân tử ở Việt Nam. C. elegans còn có thể trở thành sinh vật mô hình thực hành cho nhiều chủ đề trong sinh học, ví dụ như thực hành các quy luật di truyền Mendel. Ngoài các trang thiết bị phổ biến cho thí nghiệm liên quan đến sinh học phân tử, các thiết bị cần thiết cho nghiên cứu trên C.elegans là những thiết bị với "giá thấp" như tủ nuôi cấy ổn định nhiệt độ (16, 20 và 25 oC), kính hiển vi và hệ vi tiêm. Vì vậy xét trên nhiều góc độ, C. elegans hoàn toàn có thể là một trong số lựa chọn thiết thực để góp phần phát triển nghiên cứu và đào tạo khoa học sự sống ở Việt Nam.
Hiện nay chúng tôi đang sử dụng một số loài giun tròn thuộc chi Caenorhabditis bao gồm cả C. elegans trong hai nghiên cứu độc lập. Nghiên cứu thứ nhất là về tiến hóa sinh vật, bao gồm: phân lập giun Caenorhabditis từ nhiều vùng sinh thái thuộc lãnh thổ Việt Nam và xác định đa dạng di truyền-thích nghi sinh thái của các loài giun này. Kết quả nghiên cứu giúp mô phỏng lịch sử tiến hóa/chọn lọc của giun tròn Caenorhabditis ở các vùng sinh thái ở Việt nam. Nghiên cứu thứ hai về tác động của giới cái lên hành vi của giới đực nhằm góp phần quản lý những tác động của sự chênh lệch giới thụ động trong xã hội loài người trong đó có Việt Nam.

Hình 4: Nhóm sinh viên làm thí nghiệm trên C. elegans.
Kết luận
Con người đã sử dụng tuyến trùng giun tròn Caenorhabditis elegans làm sinh vật mô hình trong nghiên cứu sinh học và đã tìm ra nhiều quy luật sinh học phục vụ cho hiểu biết và ứng dụng trong đời sống. Giun mô hình này có những ưu thế thuận lợi cho nghiên cứu nhiều quy luật sinh học ở mức độ phân tử, cũng như đào tạo khoa học sự sống trong điều kiện hạn chế về kinh phí và cơ sở vật chất của Việt Nam.
Tác giả : T.S. Lê Thọ Sơn được đào tạo thạc sỹ tại Học viện Gwangju Institute of Science and Technology và tiến sỹ tại Đại học Hanyang, Hàn Quốc năm và sau tiến sĩ tại Học viện Academia Sinica, Đài Loan. Tác giả đã nghiên cứu enzym dehydrogenase và tiến hóa kích thước hệ gen sinh vật trên mô hình C. elegans.
Tài liệu tham khảo:
-------------------------------
Cập nhật: 05/03/2016



Add new comment