Trần Phương Anh 1,2
1. Nice – Sophia Antipolis University
2. Nha Trang University
Nhiều thập kỷ trôi qua, y học thế giới đã có những nổ lực không ngừng và đạt được nhiều thành tựu vượt bậc trong cuộc chiến chống lại những căn bệnh hiểm nghèo như ung thư, bệnh truyền nhiễm, tim mạch…Tuy nhiên, ung thư vẫn còn là mối đe doạ gây tử vong hàng đầu do việc chuẩn đoán và điều trị chưa kịp thời và hữu hiệu.
Việc phát hiện những phân tử microRNA và chức năng của chúng trong điều hoà biểu hiện gen là một trong những khám phá nổi bật của ngành di truyền học 30 năm qua. Đặc biệt, nhiều nghiên cứu đã chứng minh những biểu hiện bất thường của microRNA liên quan đến sự hình thành và phát triển của các loại ung thư. Chính vì vậy, microRNA đã trở thành chủ đề nghiên cứu thu hút nhiều sự quan tâm của các nhà khoa học.
Bài viết này nhằm giới thiệu sơ lược về microRNA, vai trò cũng như tiềm năng trong chuẩn đoán và điều trị ung thư.
Micro RNA và chức năng
Micro RNA (miRNA, miR) là những phân tử RNA không mã hoá, độ dài khoảng 18-25 nucleotides (nts) và có vai trò quan trọng trong việc điều hoà biểu hiện gen sau phiên mã ở th. (1) miR chủ yếu có chức năng ức chế biểu hiện một hoặc nhiều gen đích bằng cách tương tác với vùng không dịch mã (3’-UTR) của các RNA thông tin (mRNA) tương ứng.
Kể từ khi Victor Ambros phát hiện miR đầu tiên trên giun, lin-4, vào năm 1993 , đến nay đã có hơn 20.000 miR được xác định ở động vật, thực vật và virus, trong đó hơn 2.000 miR ở người và có thể điều hoà đến hơn 60% toàn bộ hệ gen người (www.mirbase.org).
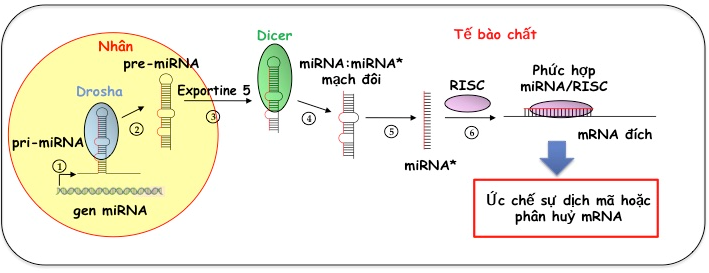
Hình 1. Tổng quan quá trình hình thành miR ở động vật gồm 6 bước: (1) Sự tạo thành pri-miR bằng cách phiên mã các gen miR bởi enzyme RNA polymerase III; (2) Nhờ enzyme Drosha, các pri-miR được cắt thành những đoạn pre-miR ngắn hơn; (3) Sự vận chuyển pre-miR từ nhân ra ngoài tế bào chất; (4) Sự cắt pre-miR thành các miR có mạch đôi nhờ enzyme Dicer; (5), (6) Một mạch miR được lựa chọn và kết hợp với RISC tạo phức RISC/miR và tương tác với đoạn mRNA đích.
Theo hình 1, quá trình hình thành miR ở động vật bắt đầu ở nhân: các gen mã hoá cho miR được phiên mã bởi RNA polymerase III, tạo những phân tử tiền chất RNA, gọi là primary RNA (pri-miR) có cấu trúc vòng thân điển hình (Hình 1, bước 1). Các pri-miR này sau đó bị cắt bởi enzyme Drosha (ribonuclease III) thành các precursor-miRNA (pre-miR), có chiều dài khoảng 70 nts và cấu trúc “kẹp tóc” (hairpin) (Hình 1, bước 2). Sau khi được vận chuyển từ nhân ra ngoài tế bào chất (Hình 1, bước 3), dưới tác động của enzyme Dicer (ribonuclease III), các pre-miR này bị cắt thành những đoạn miR mạch đôi (21-25 nts) (Hình 1, bước 4). Tiếp theo, chỉ một mạch miR kết hợp với RISC (RNA-induced silencing complex) tạo phức hợp RISC/miR (Hình 1, bước 5&6). Phức hợp RISC/miR này sau đó liên kết bổ sung với mRNA đích, dẫn đến ức chế sự dịch mã (repression mRNA translation) hoặc phân huỷ các mRNA này (mRNA degradation), qua đó kiểm soát biểu hiện gen tương ứng.
Các nghiên cứu cho thấy miR điều tiết biểu hiện gen, tham gia vào các quá trình sinh lý và bệnh lý của cơ thể (sự hình thành, phát triển, biệt hoá và thậm chí là cái chết của tế bào). Chính vì vậy, sự biến đổi của miR, sự rối loạn chức năng của quá trình sinh tổng hợp miR (miR biogenesis) hoặc sự rối loạn biểu hiện của miR có thể gây ra nhiều loại ung thư. Qua đó, miR trở thành một đích sinh học tiềm năng trong nghiên cứu y sinh, nhằm tìm ra các phương pháp điều trị và chuẩn đoán ung thư và đã có rất nhiều nghiên cứu liên quan đến miR được báo cáo. (7, 8)
MicroRNA và ung thư
Theo ước tính gần đây, ung thư chiếm 34% trong tổng số các bệnh liên quan đến sự rối loạn biểu hiện miR ở người, tiếp theo là các bệnh miễn dịch và nhiễm trùng (15%), tim mạch (7%) và các loại bệnh khác.
Sự rối loạn biểu hiện miR ở ung thư được chia thành hai nhóm chính: biểu hiện dư miR (up-regulated miR) và biểu hiện thiếu miR (down-regulated miR). Nếu một miR được biểu hiện dư và ức chế quá trình tổng hợp một hoặc nhiều protein ức chế khối u (tumor suppressor protein), đó là các miR gây ung thư (oncogenic miR, oncomiR). Ngược lại, nếu một miR được biểu hiện thiếu và ức chế sự tổng hợp một hay nhiều protein gây ung thư (oncogenic proteins), đó là các miR ức chế khối u (tumor suppressor miR). (Hình 2).
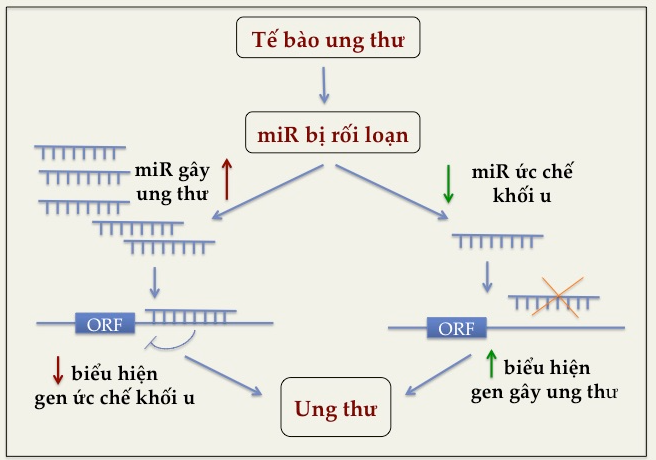
Hình 2. miR gây ung thư (oncogenic miRNA) và miR ức chế khối u (tumor suppressor miRNA).
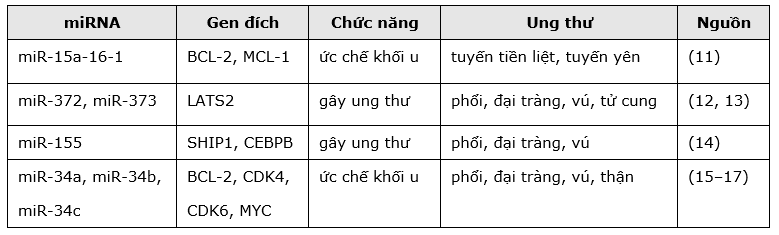
Lưu ý rằng một miR được cho là miR gây ung thư hay miR ức chế khối u phải được xác định trên một loại tế bào cụ thể. Bởi một số miR có thể là miR gây ung thư trên loại tế bào này, nhưng lại là miR ức chế khối u trên tế bào khác. Ví dụ, miR-221 đóng vai trò là một miR gây ung thư trong gan do ức chế biểu hiện của protein PTEN (the tumor suppressor phosphatase and tensin homolog), trong khi miR-221 trong ung thư máu (erythrobaslic leukemia) lại là miR ức chế khối u do ức chế biển hiện của protein gây ung thư KIT (tyrosine-protein kinase). Có thể giải thích là do một miR có thể tương tác với nhiều mRNA đích, cũng như một mRNA cũng có thể là mRNA đích của nhiều miR khác nhau trong các loại tế bào khác nhau. (10) Chính vì vậy, một miR có thể đồng thời tham gia vào nhiều quá trình khác nhau, có những tác động khác nhau lên sự tồn tại, tăng trưởng và phát triển của các loại tế bào khác nhau. Bảng 1 liệt kê một số miR, chức năng và gen đích của chúng trong ung thư.
Bảng 1: Một số miR, gen đích và chức năng trong ung thư.
Mir và những ứng dụng trong nghiên cứu ung thư
Hiện nay, rất nhiều nghiên cứu tập trung vào việc sử dụng miR như những công cụ hiệu quả trong chuẩn đoán và chữa trị ung thư. Đầu tiên, miR có thể là chất chỉ điểm sinh học (biomarker) cho việc chẩn đoán và phân loại ung thư nhờ vào biểu hiện riêng biệt (specific signature) của miR trong ung thư. Thật vậy, từng loại ung thư và các giai đoạn phát triển của nó sẽ có một dấu hiệu miR riêng biệt. Như vậy, hầu hết các dạng ung thư có thể được phân loại thành những nhóm nhỏ hơn nhờ vào các dấu hiệu riêng biệt này. Hơn nữa, nhờ vào dữ liệu biểu hiện của các miR (miR expression profiles), các khối u ít biệt hoá (poorly differentiated tumors) được phân loại, trong khi việc sử dụng dữ liệu của các mRNA cho kết quả không chính xác khi áp dụng trên cùng một mẫu kiểm tra. Ngoài ra, nhờ vào kích thước nhỏ, miR tương đối bền với các enzyme RNase, cho thấy, miR hứa hẹn sẽ là ứng viên tiềm năng cho việc chẩn đoán ung thư trong các dạng dịch chất (huyết thanh, nước tiểu, máu…).
Một ứng dụng quan trọng khác của miR, đó là một công cụ hiệu quả cho sự phát triển các liệu pháp chữa trị mới chống ung thư. Cả miR gây ung thư và miR ức chế khối u đều đóng vai trò then chốt trong sự phát triển của ung thư, do đó chúng có tiềm năng trở thành “đích sinh học” (biological targets). Có hai phương pháp “nhắm đích” của miR được nghiên cứu rộng rãi: 1) ức chế sự tăng biểu hiện của các miR gây ung thư và 2) bổ sung sự giảm biểu hiện của các miR ức chế khối u. Sử dụng các oligonucleotide hoặc những phân tử kích thước nhỏ (small molecule) (được thiết kế và tổng hợp) nhằm trực tiếp ức chế hay hoạt hoá các miR cũng như can thiệp vào quá trình sinh tổng hợp của miR là 2 hướng nghiên cứu thu hút các nhà khoa học nhất hiện nay. (7, 8)
Thành tựu nổi bật nhất cho đến nay của việc sử dụng miR làm đích sinh học trong nghiên cứu ung thư, đó là việc thử nghiệm lâm sàng của MRX34 trên bệnh nhân ung thư gan. (21) MRX34 là một liposome có mạch đôi được thiết kế “bắt chước” cấu trúc của miR-34 – miR ức chế khối u bị giảm biểu hiện trong nhiều khối u ác tính và ung thư máu. miR-34 điều hoà sinh tổng hợp gen ức chế khối u p53 và của hơn 20 gen liên quan đến ung thư: BCL2, E2F3, HDAC1, MET, MEK1, CDK4/6…(22) Đây là lần đầu tiên một miR người được đưa vào thử nghiệm lâm sàng (2013) và đã đạt nhiều kết quả khả quan, hứa hẹn tiềm năng sử dụng miR trong chữa trị ung thư.
Kết luận
Với vai trò then chốt trong điều hoà biểu hiện gen giai đoạn sau phiên mã, sử dụng miRNA để chẩn đoán và chữa trị ung thư đã và đang gặt hái nhiều thành công, giúp hé mở nhiều điều bí ẩn trong thế giới của các RNA không mã hoá protein (non-protein coding RNAs) – những RNA thường bị lãng quên này chiếm đến 97% RNA sau khi đã được phiên mã từ hệ gen. Hi vọng trong tương lai gần, nhiều nghiên cứu sâu hơn về miR có thể mang lại một bước đột phát trong cuộc chiến chống lại các bệnh nan y, đặc biệt là ung thư.
List of figures:
Hình 1. Tổng quan quá trình hình thành miR ở động vật, gồm 6 bước.
Hình 2. miR gây ung thư (oncogenic miRNA) và miR ức chế khối u (tumor suppressor miRNA).
Bảng 1: Một số miR, gen đích và chức năng trong ung thư.
REFERENCES
1. Ambros V (2008) The evolution of our thinking about microRNAs. Nat Med 14(10):1036–1040.
2. Lee RC, Feinbaum RL, Ambros V (1993) The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 75(5):843–854.
3. Kim VN, Han J, Siomi MC (2009) Biogenesis of small RNAs in animals. Nat Rev Mol Cell Biol 10(2):126–139.
4. Bartel DP (2004) MicroRNAs: Genomics, Biogenesis, Mechanism, and Function. Cell 116(2):281–297.
5. Dong H, et al. (2013) MicroRNA: Function, Detection, and Bioanalysis. Chem Rev 113(8):6207–6233.
6. Sevignani C, Calin GA, Siracusa LD, Croce CM (2006) Mammalian microRNAs: a small world for fine-tuning gene expression. Mamm Genome 17(3):189–202.
7. Ling H, Fabbri M, Calin GA (2013) MicroRNAs and other non-coding RNAs as targets for anticancer drug development. Nat Rev Drug Discov 12(11):847–865.
8. Li Z, Rana TM (2014) Therapeutic targeting of microRNAs: current status and future challenges. Nat Rev Drug Discov 13(8):622–638.
9. Jayaraj GG, Nahar S, Maiti S (2014) Nonconventional chemical inhibitors of microRNA: therapeutic scope. Chem Commun 51(5):820–831.
10. Calin GA, Croce CM (2006) MicroRNA signatures in human cancers. Nat Rev Cancer 6(11):857–866.
11. Cimmino A, et al. (2005) miR-15 and miR-16 induce apoptosis by targeting BCL2. Proc Natl Acad Sci U S A 102(39):13944–13949.
12. Cho WJ, et al. (2009) miR-372 regulates cell cycle and apoptosis of ags human gastric cancer cell line through direct regulation of LATS2. Mol Cells 28(6):521–527.
13. Voorhoeve PM, et al. (2006) A genetic screen implicates miRNA-372 and miRNA-373 as oncogenes in testicular germ cell tumors. Cell 124(6):1169–1181.
14. Faraoni I, Antonetti FR, Cardone J, Bonmassar E (2009) miR-155 gene: A typical multifunctional microRNA. Biochim Biophys Acta BBA - Mol Basis Dis 1792(6):497–505.
15. Christoffersen NR, et al. (2010) p53-independent upregulation of miR-34a during oncogene-induced senescence represses MYC. Cell Death Differ 17(2):236–245.
16. Toyota M, et al. (2008) Epigenetic silencing of microRNA-34b/c and B-cell translocation gene 4 is associated with CpG island methylation in colorectal cancer. Cancer Res 68(11):4123–4132.
17. Cole KA, et al. (2008) A Functional Screen Identifies miR-34a as a Candidate Neuroblastoma Tumor Suppressor Gene. Mol Cancer Res 6(5):735–742.
18. Volinia S, et al. (2006) A microRNA expression signature of human solid tumors defines cancer gene targets. Proc Natl Acad Sci U S A 103(7):2257–2261.
19. Lu J, et al. (2005) MicroRNA expression profiles classify human cancers. Nature 435(7043):834–838.
20. Lawrie CH (2008) microRNA expression in lymphoid malignancies: new hope for diagnosis and therapy? J Cell Mol Med 12(5a):1432–1444.
21. Bouchie A (2013) First microRNA mimic enters clinic. Nat Biotechnol 31(7):577–577.
22. Beg MS, et al. (2014) Abstract CT327: Multicenter phase I study of MRX34, a first-in-class microRNA miR-34 mimic liposomal injection. Cancer Res 74(19 Supplement):CT327–CT327.


