Hợp chất thiên nhiên trong hóa trị ung thư
Trần Thị Hồng Loan1,2,3,*; Nguyễn Minh Hiền1
1 Khoa Hóa, Trường Đại học Sư phạm, Đại học Đà Nẵng, Đà Nẵng.
2 Viện Nghiên cứu Thiên nhiên, Đại học Y Cao Hùng, Cao Hùng, Đài Loan.
3 Trung tâm Nghiên cứu Bệnh Truyền nhiễm và Ung thư, Đại học Y Cao Hùng, Cao Hùng, Đài Loan.
* Mọi thắc mắc xin liên hệ: tranhongloan912@gmail.com hoặc u105831005@kmu.edu.tw.
Từ khoá: Hợp chất thiên nhiên; ung thư; hóa trị.
Giới thiệu (Abstract)
Ung thư hiện nay đang là căn bệnh có mức độ tử vong cao cùng với tốc độ phát triển nhanh tại Việt Nam. Tìm kiếm các loại thuốc mới có độc tính trên nhiều dòng ung thư khác nhau, ít tác dụng phụ đang là ưu tiên hàng đầu. Hiện nay, các nhà khoa học trên thế giới và Việt Nam đặt nhiều quan tâm vào các hợp chất thiên nhiên có hoạt tính chống ung thư. Từ các bài thuốc dân gian đến việc sàng lọc các hợp chất có hoạt tính sinh học trên quy mô lớn, đến nay chúng ta đã có nhiều loại thuốc ung thư được thương mại hoá có nguồn gốc thiên nhiên. Bài báo này cung cấp cái nhìn khái quát dựa theo trục thời gian về khám phá và ứng dụng các hợp chất thiên nhiên trong điều trị ung thư, cơ chế sinh học của một số hợp chất tiêu biểu cũng như thách thức của lĩnh vực này tại Việt Nam trong thời gian sắp đến.
Lịch sử nghiên cứu thuốc điều trị ung thư từ các chế phẩm thiên nhiên
Bệnh ung thư mang đến nhiều hệ luỵ về sức khoẻ, có thể gây ra cái chết cho bệnh nhân nếu không được chẩn đoán và điều trị kịp thời. Theo số liệu mới nhất được đăng trên website của Tổ chức Y tế Thế giới (WHO), ung thư được xác định là nguyên nhân hàng đầu gây ra tử vong trên khắp thế giới; năm 2012, có xấp xỉ 14 triệu ca bệnh ung thư mới và hơn 8 triệu cái chết liên quan đến ung thư. Số lượng ca bệnh ung thư mới được dự đoán tăng hơn 70% trong hai thập kỉ. Theo Báo cáo tổng quan ngành Y tế do Bộ Y tế Việt Nam công bố năm 2015, số người mới mắc ung thư ở Việt Nam là hơn 125.000 năm 2012 và ước tính con số này sẽ tăng lên gần 190.000 vào năm 2020 (1). Tìm kiếm các loại thuốc mới có khả năng tiêu diệt nhiều dòng tế bào ung thư khác nhau, đồng thời giảm thiểu tác dụng phụ của thuốc là yêu cầu cấp thiết hiện nay. Có nhiều con đường để tìm kiếm các thuốc điều trị ung thư mới nhưng hợp chất có nguồn gốc thiên nhiên vẫn là một nguồn quan trọng.
Không phải từ bây giờ mà từ hàng ngàn năm trước, con người đã sử dụng các loại thực vật trong việc điều trị nhiều loại bệnh khác nhau. Hơn 50 năm trước, hợp chất thiên nhiên bắt đầu đóng vai trò quan trọng trong tìm kiếm thuốc điều trị ung thư. Hai loại thực vật đầu tiên được nghiên cứu là Podophyllum peltatum (Táo ma) và Catharanthus roseus (Dừa cạn) (2). Nghiên cứu này khởi nguồn từ bài thuốc dân gian của người Ấn Độ tại Mỹ sử dụng dịch chiết từ rễ cây Táo ma để điều trị ung thư da và bệnh sùi mào gà. Các nghiên cứu chỉ ra rằng thành phần chính của cây Táo ma là Podophyllotoxin. Đây là tiền thân của nhóm hợp chất điều trị ung thư Podophyllins. Một số thuốc điều trị ung thư thường được sử dụng hiện nay nằm trong nhóm Podophyllins là Etoposide và Teniposide. Một ví dụ tương tự là cây Dừa cạn. Đây là một loại cây thân thảo, sống lâu năm, mọc và phân bố ở các nước nhiệt đới như Việt Nam, Ấn Độ, Philippines. Cây dừa cạn được dùng trong y học cổ truyền tại nhiều nước để chữa bệnh đái tháo đường (3). Tuy nhiên đến tận năm 1958, hai thành phần chính của cây Dừa cạn là Vinblastine và Vincristine mới được chứng minh có khả năng tiêu diệt tế bào ung thư (2).
Những thành công trong nghiên cứu hợp chất thiên nhiên đã thúc đẩy Viện Nghiên Cứu Ung thư Quốc gia (National Cancer Institute, NCI) của Hoa Kì khởi động dự án khảo sát hợp chất thiên nhiên trong điều trị ung thư vào những năm 1960. Từ năm 1960 đến năm 1982, 35.000 loài thực vật đã được lấy mẫu và kiểm tra khả năng tiêu diệt dòng tế bào ung thư máu của chuột L1210 và P388 (4). Một trong những hợp chất quan trọng được tìm thấy trong dự án này là Paclitaxel (Taxol). Taxol là một hợp chất được tìm thấy từ quá trình phân lập từ vỏ cây Taxus brevifolia (cây Thông đỏ). Taxol được sử dụng trong điều trị ung thư buồng trứng, ung thư vú, ung thư phổi, ung thư tuyến tụy và một vài loại ung thư khác. Không dừng lại ở đó, vào năm 1985, NCI tiếp tục khởi động dự án nghiên cứu liên quan đến hợp chất thiên nhiên. Dự án này đã mở rộng các chủng loại dược liệu nghiên cứu bao gồm thực vật, động vật, vi sinh vật và đặc biệt quan tâm đến các loại dược liệu có nguồn gốc từ sinh vật biển. Đây là bước khởi đầu cho các nghiên cứu về hợp chất thiên nhiên có nguồn gốc từ sinh vật biển, một hướng mới đang thu hút được sự quan tâm hiện nay. Bên cạnh việc mở rộng các chủng loại thực vật, NCI mở rộng các dòng tế bào ung thư bao gồm cả các dòng ung thư khối u (ung thư phổi, ung thư vú, ung thư não..) và một vài dòng ung thư máu. Trong 5 năm đầu tiên của dự án, 100.000 mẫu vật liệu đã được kiểm tra bao gồm dịch chiết và hợp chất được phân lập, có hơn 60 dòng tế bào đã được khảo sát. Chương trình đã nhận diện được một loạt hợp chất có khả năng tiêu diệt các tế bào ung thư khối u, tuy nhiên không tìm thấy hợp chất có tác dụng điều trị tế bào ung thư máu. Trong 5 năm tiếp theo, từ 1990 đến 1995, dưới sự hỗ trợ của những bước tiến trong nghiên cứu về tế bào ung thư đã tạo nên tảng cho nghiên cứu cơ chế sinh học phân tử tương các giữa hợp chất thiên nhiên và tế bào ung thư (4). Các dữ liệu thu thập được cung cấp một nguồn thông tin vô cùng quý giá đối với việc nghiên cứu các thuốc điều trị ung thư mới.
Những thập niên gần đây, chúng ta đã chứng kiến sự phát triển vượt bậc về kĩ thuật và công nghệ trong lĩnh vực tìm kiếm, phát triển các thuốc điều trị ung thư. Trong cuộc cạnh tranh khốc liệt này, hợp chất thiên nhiên vẫn là một hướng đi tiềm năng, hứa hẹn những đóng góp đáng kể.
Thực vật là nguồn nguyên liệu quan trọng trong tìm kiếm các loại thuốc điều trị ung thư
Từ xa xưa, người Châu Á đã biết sử dụng thực vật trong việc điều trị ung thư. Bài thuốc “Danggui Longhui Wan”, một bài thuốc cổ truyền người Trung Quốc kết hợp 11 loại dược liệu khác nhau, được sử dụng để điều trị cho bệnh nhân ung thư máu mãn tính (5). Hartwell một người tiên phong trong lĩnh vực đã công bố một danh sách hơn 3000 loài thực vật có khả năng sử dụng trong điều trị ung thư trong quyển “Plants Used Against Cancer” (6).
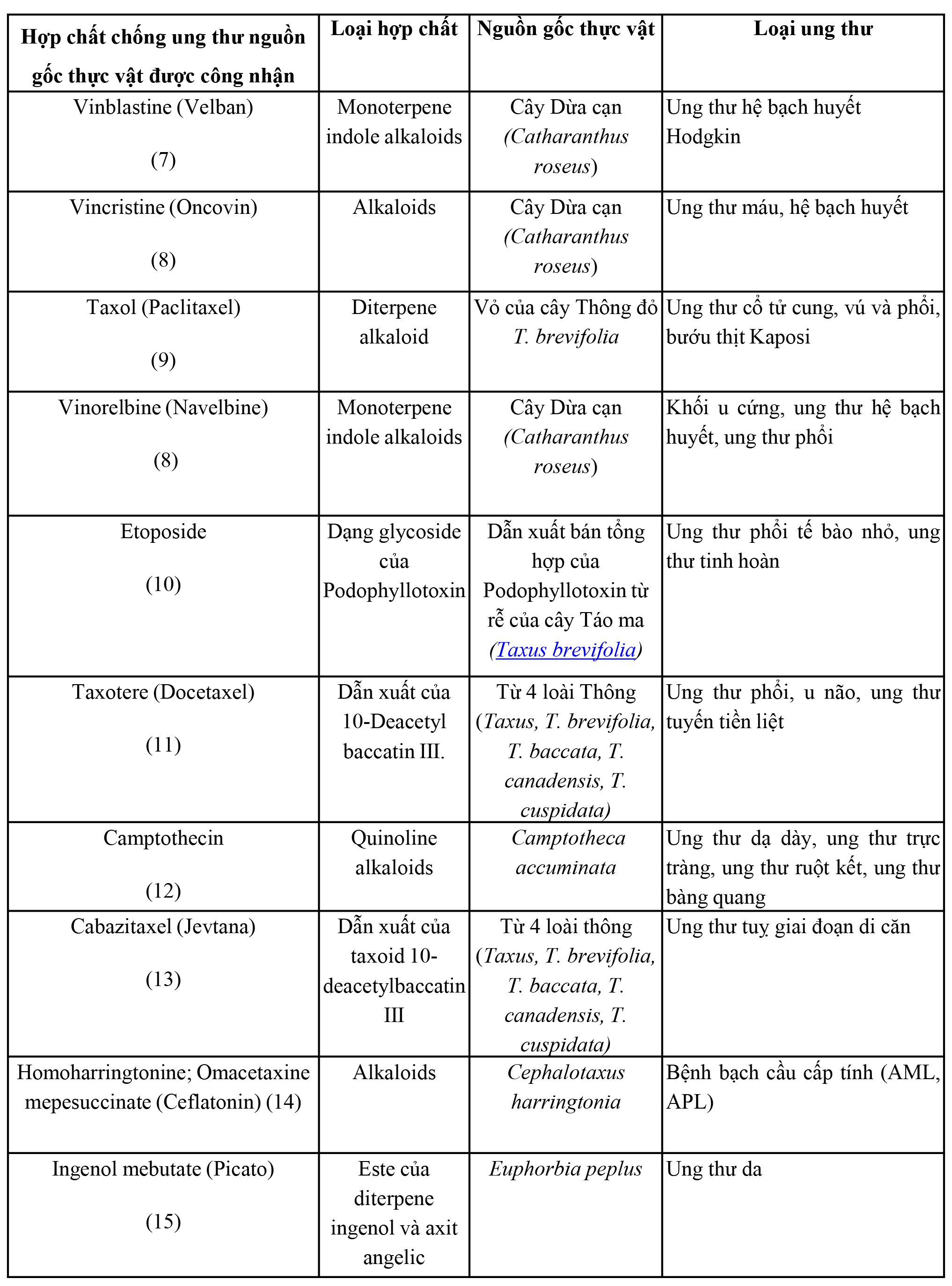
Những thành công bước đầu trong nghiên cứu hợp chất thiên nhiên đã tạo động lực cho cuộc tìm kiếm các thuốc điều trị ung thư từ thực vật. Khám phá và phát triển thuốc điều trị ung thư Vinblastine, Vincristine, và Podophyllotoxins là nền tảng cho hàng loạt những nghiên cứu về hợp chất thiên nhiên trong điều trị ung thư sau này (Bảng 1). Nối tiếp thành công là một loạt thuốc mới có nguồn gốc thực vật được tìm thấy, tiêu biểu là Taxol, Etoposide, Camptothecin (Bảng 1). Tại Mỹ, từ năm 1961 tính đến 2014 có 13 hợp chất từ thực vật được cấp phép sử dụng như thuốc điều trị ung thư. Số lượng chủng loại và doanh số bán ra của các thuốc ung thư có nguồn gốc thực vật là minh chứng rõ ràng về vai trò của thực vật như một nguồn lợi to lớn. Một số hợp chất được liệt kê trong bảng sau:
Bảng 1. Các thuốc điều trị ung thư có nguồn gốc thực vật được thương mại hóa
Khác với Vinblastine hay các dẫn xuất của nó, Taxol cho thấy mô hình cơ chế hoạt động khác hẳn, Taxol bền hoá ống vi thể trong suốt quá trình phân chia tế bào (16). Điều này cho phép thiết lập mối tương quan giữa cấu trúc và hoạt tính của hàng trăm các dẫn xuất bán tổng hợp, hợp chất được biết đến nhiều nhất trong nhóm hợp chất này là Taxotere (11). Bristol-Mayers Squibb, Mỹ là công ty được cho phép sản xuất Taxol ở quy mô thương mại, ước tính nhu cầu Taxol hàng năm là 250 kg cho toàn thế giới. Trong lúc doanh thu của Taxotere là 3 tỉ đô vào năm 2009 và chỉ riêng Taxane và Camptothecin đã chiếm một phần ba thị phần thuốc chống ung thư toàn cầu (17).
Các thuốc điều trị ung thư từ vi sinh vật
Bên cạnh thực vật, vi sinh vật cũng là một chìa khóa trong việc nghiên cứu các thuốc điều trị ung thư từ hợp chất thiên nhiên. Đáng chú ý trong số đó là Bleomycins (Blenoxane), Dactinomycin, Mitomycin C, Anthracyclinones, Daunomycin và Doxorubicin (Adriamycin). Một trong những loại thuốc điều trị ung thư nổi bật trong nhóm này là Doxorubixin, một kháng sinh thuộc nhóm Anthracyclin gây độc tế bào được phân lập từ môi trường nuôi cấy vi khuẩn Streptomyces peucetius var. caecius (18,19). Doxorubinxin được Tổ chức Y tế Thế giới xếp vào danh sách một trong những loại thuốc quan trọng nhất trong nhóm thuốc chăm sóc sức khỏe cơ bản. Một thuốc nổi bật khác là Epothilones. Bộ khung Epothilone được phát hiện lần đầu tiên vào năm 1993 trong dịch chiết của loài Myxobacterium tên là Sorangium cellulosum (20). Cơ chế hoạt động của Epothilones tương tự Taxol, đồng thời co điểm nổi trội đó là dễ hoà tan trong nước , phù hợp công nghệ lên men (fermentation technology )(2). Tháng 10 năm 2007, Cơ quan kiểm định Thực phẩm và Dược phẩm (FDA) Hoa kì đã cấp phép cho Ixabepilone, một loại thuốc có bộ khung Epothilone được nghiên cứu và phát triển bởi công ty dược phẩm Hoa Kì Bristol-Myers Squibb (21). Ixabepilone được sử dụng trong hóa trị ung thư đối với những trường hợp ung thư đã di căn và ung thư vú không đáp ứng với các loại thuốc ung thư có sẵn hiện nay.
Các thuốc điều trị ung thư có nguồn gốc từ sinh vật biển
Hướng nghiên cứu các thuốc điều trị ung thư từ sinh vật biển là một hướng mới, có lịch sử phát triển ngắn. Hợp chất có hoạt tính sinh học đầu tiên được tìm thấy đó là Spongourdine và Spongothymidine từ một loài bọt biển (sea sponge), Cryptotheca crypta (22). Thuốc đầu tiên có nguồn gốc từ biển là Ziconotide ( -conotoxin MVIIA) - một chuỗi peptit (peptide) có nguồn gốc từ loài Ốc nón nhiệt đới. Thuốc này được Mỹ chứng nhận vào năm 2004 có tên thương mại là Prialt được sử dụng để điều trị cơn đau mãn tính do tổn thương tủy sống (23). Theo cơ quan kiểm định thực phẩm dược phẩm Mỹ (FDA) và Đại diện châu Âu về đánh giá các thuốc (EMA), từ năm 1940 đến 2010, có 113 thuốc chống ung thư có nguồn gốc thiên nhiên được chứng nhận, trong đó có 3 thuốc có nguồn gốc từ sinh vật biển bao gồm Cytarabine, Trabectedin và Eribulin (24).
Hướng hợp chất thiên nhiên từ sinh vật biển có độc tính tiêu diệt tế bào ung thư chỉ thật sự thu hút sự quan tâm của nhà khoa học và phát triển mạnh mẽ từ những năm giữa cuối thế kỷ 20, mặc dù sớm có những kết quả khả quan. Vào năm 2012, 118 hợp chất chống ung thư có nguồn gốc từ biển bắt đầu thử nghiệm tiền lâm sàng, 22 cấu trúc đang trong thời gian thử nghiệm lâm sàng (25). Năm 2004, Blunt và đồng nghiệp đã lập ra một danh sách những hợp chất có hoạt tính sinh học có nguồn gốc từ biển: Động vật thân lỗ (37%) (Sponges), Động vật ruột khoang (21%) (Coelenterates) và các Vi sinh vật (18%) (Microorganisms) như những nguồn chính, theo sau là Tảo (9%) (Algae), Động vật da gai (6%) (Echinoderms), Tunicate (6%), Động vật thân mềm (2%) (Molluscs) và Động vật hình rêu (1%) (Bryozoans) (21). Dựa vào báo cáo và kết quả phân tích số liệu, các nhà khoa học dự đoán rằng tìm kiếm các hợp chất thiên nhiên từ sinh vật biển có tỷ lệ tăng khoảng 10% mỗi năm (26). Tháng 10 năm 2007, Trabectedin trở thành hợp chất chống ung thư đầu tiên có nguồn gốc từ biển được Hội đồng Châu Âu chứng nhận (23). Hợp chất được tìm thấy trong dịch chiết loài Hải tiêu Ecteinascidia turbinate. Trabectedin có tên thương mại là Yondelis, được dùng để điều trị ung thư mô mềm và ung thư buồng trứng trong trường hợp bệnh nhân đã kháng các thuốc ung thư thế hệ cũ (23). Một hợp chất khác là Aplidine, một peptit (peptide) vòng, cũng được sử dụng trong nghiên cứu điều trị bệnh bạch cầu cấp tính (27). Gần đây nhất tháng 11 năm 2010, Eribulin mesylate (Halavenw) được công nhận bởi FDA trong việc điều trị cho các bệnh nhân ung thư vú di căn, những người mà trước đó không đáp ứng tốt với hoá trị bởi Anthracycline và Taxane (28). Eribulin mesylate (E7389, ER-086526, NSC 707389, Halavenw) là một dạng cấu trúc đơn giản hoá của Macrolide halichondrin B, được phân lập từ Halichondria okadai, một loài hải miên sống ở vùng biển Nhật Bản (29). Trong những năm gần đây, rất nhiều hợp chất tự nhiên có nguồn gốc từ sinh vật biển có hoạt tính kháng tế bào ung thư được tìm thấy, hứa hẹn là những sản phẩm thuốc sử dụng trong hoá trị ung thư trong tương lai gần. Một trong số đó là Plitidepsine, một depsipeptide dạng vòng được phân lập từ động vật Túi nang Aplidium albicans Địa Trung Hải. Plitidepsine thể hiện hoạt tính cao với nhiều dòng ung thư khác nhau như ung thư hệ bạch huyết, ung thư máu, và ung thư da dù chỉ ở nồng độ rất thấp nanomol (30). Ngoài ra còn có Plinabulin (KPU-2, NPI-2358) một dạng dẫn xuất của Halimide bằng cách thay đổi vòng phenyl, nhờ vậy mà hoạt tính tăng lên đáng kể. Cuối cùng là Halimide, dạng chuyển hoá diketopiperazine được chiết xuất từ nấm biển Aspergillus ustus và cho thấy hoạt tính kháng ung thư đối với ung thư ruột kết và ung thư buồng trứng (31).
Cơ chế hoạt động của một số loại thuốc điều trị ung thư tiêu biểu
Taxol
Taxol (Paclitaxel) là một thuốc điều trị ung thư quan trọng. Taxol được khám phá lần đầu tiên vào đầu những năm 1962, kết quả của chương trình kiểm tra hoạt tính các hợp chất thiên nhiên được thực hiện bởi NCI (8).
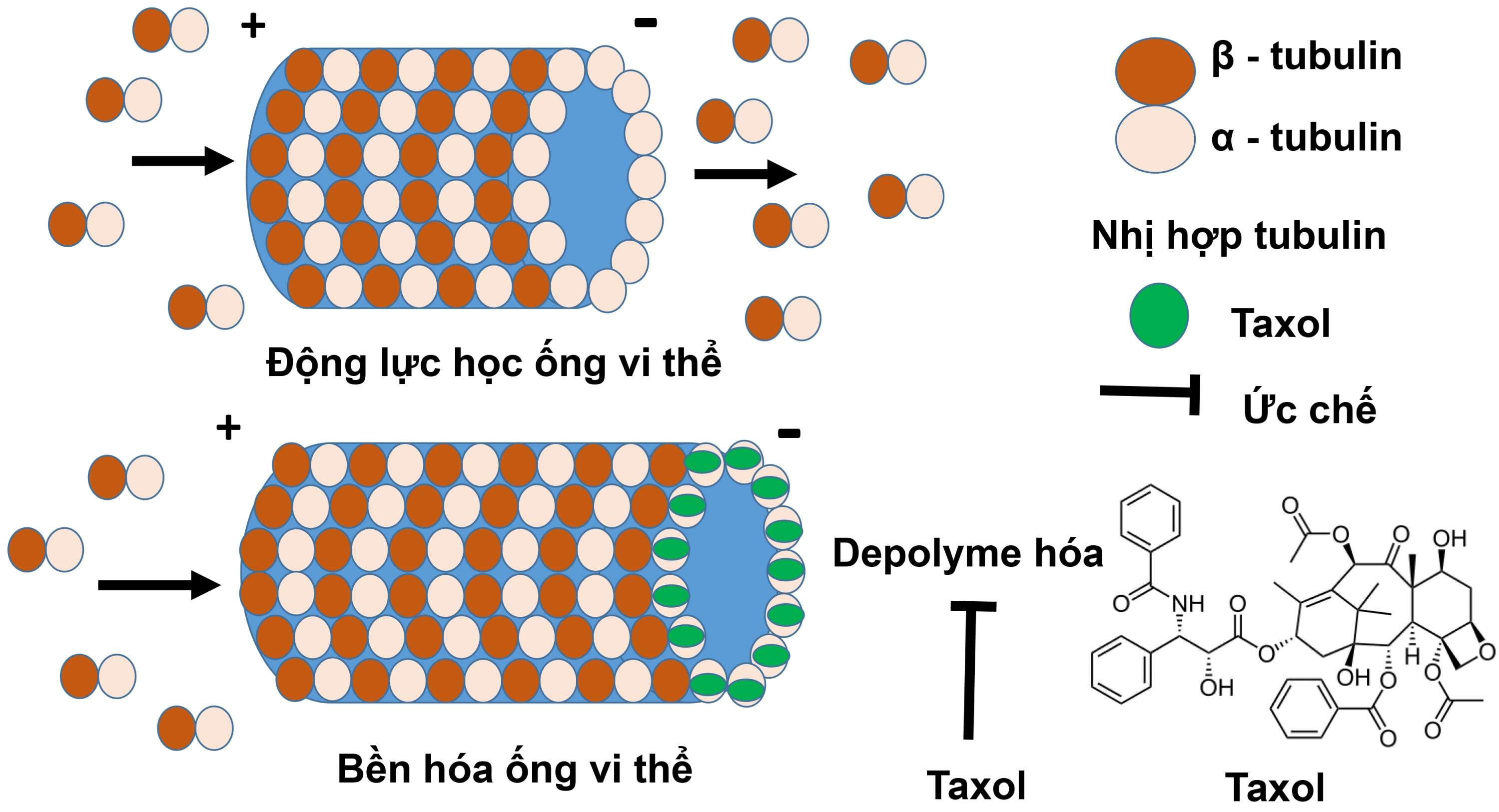
Taxol ngăn cản sự phân chia tế bào bằng cách đính trực tiếp lên bề mặt của ống vi thể. Ống vi thể đóng vai trò quan trọng trong sự tồn tại và phân chia của tế bào. Để bảo đảm chức năng sinh học, chiều dài của ống vi thể thay đổi một cách linh hoạt thông qua quá trình polyme và depolyme. Khi Taxol đính vào bề mặt của các ống vi thể, nó ức chế quá trình depolyme hóa bằng việc ngăn cản sự chuyển đổi qua lại của GTP và GDP, đồng thời, Taxol cũng giúp củng cố sự bền vững của ống vi thể (Hình 1). Do vậy, tế bào không có khả năng tiến vào Kì giữa (Metaphase) của nguyên phân, dẫn tới quá trình nguyên phân bị khóa, kéo dài trạng thái phân bào và sự chết theo chương trình của tế bào (programmed cell death, apoptosis) được khởi động (16).
|
|
|
Hình 1. Cơ chế tác dụng của Taxol lên tế bào ung thư. Taxol bám trên bề mặt ống vi thể, ức chế quá trình depolyme hóa, bền hóa ống vi thể. Kết quả, ống vi thể không thể thực hiện chức năng sinh học dẫn tới quá trình nguyên phân bị kéo dài, và sự chết theo chương trình của tế bào (programmed cell death, apoptosis) được khởi động. |
Doxorubicin
Doxorubicin là một hợp chất kháng ung thư tiêu biểu trong các hợp chất kháng ung thư có nguồn gốc từ vi sinh vật. Ban đầu, một chất có khả năng tiêu diệt tế bào ung thư được tìm thấy trong một chủng vi sinh vật là Streptomyces peucetius, được đặt tên là Daunorubicin (32). Tuy nhiên, nghiên cứu cho thấy Daunorubicin có độc tính lên hệ tim mạch có thể dẫn đến tử vong (33). Một chủng mới của Streptomyces, kết quả của sự đột biến bằng N-nitroso-N-methyl urethane, đã sản xuất ra một loại kháng sinh mới có màu đỏ và được đặt tên là Adriamycin, sau đó tên gọi của nó được thay đổi thành Doxorubucin để phù hợp với các quy ước đặt tên. Doxorubicin thể hiện hoạt tính chống ung thư mạnh hơn Daunorubicin trên các khối u chuột (18, 19).
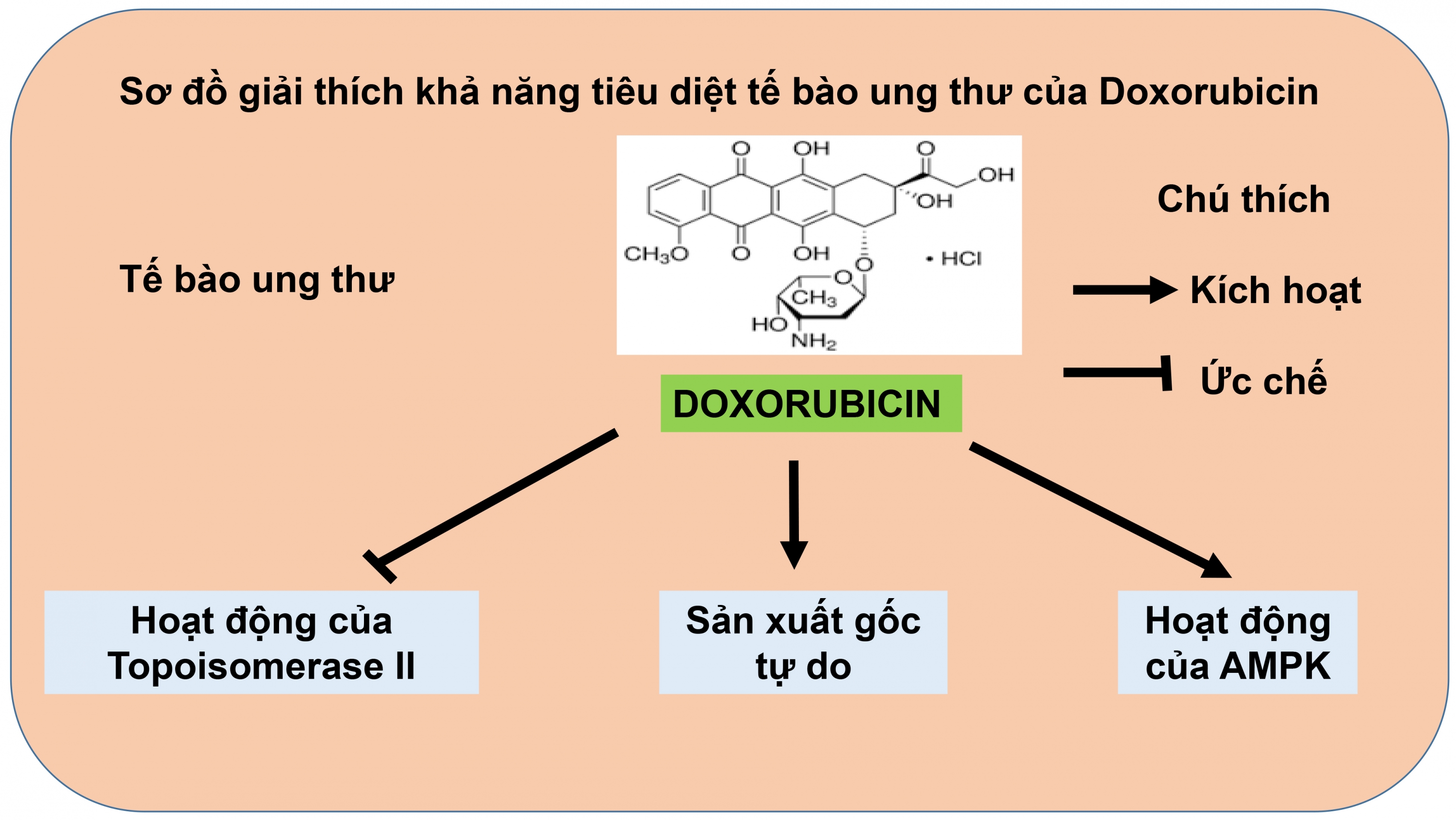
Các nghiên cứu chỉ ra rằng, Doxorubicin đính trực tiếp vào DNA, ngăn cản quá trình tự tổng hợp DNA và phiên mã (Hình 2). Doxorubicin ngăn cản hoạt động Topoisomerase II - enzyme tháo xoắn DNA. Doxorubicin cố định phức hợp của Topoisomerase II, ngăn cản quá trình tháo xoắn DNA từ đó khóa quá trình tự tổng hợp DNA cũng như quá trình phiên mã (34, 35).
Doxorubicin phát động hoạt động sản xuất các gốc tự do trong tế bào ung thư (Hình 2). Sự gia tăng các gốc tự do trong tế bào dẫn đến những tổn thương DNA và ngăn cản quá trình tự tổng hợp các đại phân tử trong tế bào. Quá trình này được gây ra bởi sự tổ hợp nhiều con đường khác nhau. Con đường đầu tiên liên quan đến sự kích hoạt phản ứng Fenton trong tế bào, sản sinh ra các gốc tự do hoạt động mạnh. Một phản ứng khác có liên quan đến quá trình này là quá trình oxi hóa trong tế bào (35).
Doxorubicin kích hoạt protein AMP kinase (AMPK) trong tế bào ung thư và kích thích quá trình tự chết (apoptosis) của tế bào (35) (Hình 2). Nghiên cứu chỉ ra rằng, Doxorobicin hoạt hóa hoạt động của AMPK trong tế bào chuột H9c2. Những nghiên cứu gần đây khám phá ra rằng, AMPK là một protein kinase hoạt động như một cảm biến năng lượng trong tế bào (intracellular energy status sensor), điều khiển quá trình sản xuất và tiêu thụ năng lượng (35). Hoạt động của AMPK kích hoạt sự hoạt động của protein p53, khởi động quá trình tự chết của tế bào đối với dòng tế bào Melanoma B16 (36). Protein p53 là một protein quan trọng trong quá trình điều hòa chu kì tế bào, có chức năng như một protein ức chế khối u (37).
|
|
|
Hình 2. Cơ chế tác dụng của Doxorubicin lên tế bào ung thư. Doxorubicin đính trực tiếp trên phân tử DNA, ức chế hoạt động của topoisomerase II, ngăn cản quá trình tháo xoắn DNA. Kết quả, DNA không thể thực hiện quá trình tự nhân đôi và phiên mã. Doxorobicin kích thích quá trình sản xuất các gốc tự do trong tế bào ung thư dẫn đến những tổn thương của DNA và ngăn cản quá trình tự tổng hợp DNA. Ngoài ra, Doxorubixin còn kích thích hoạt động của AMPK, khởi động protein áp chế khối u (tumor suppressor) p53. Trabectedin Trabectedin là một trong ba thuốc điều trị ung thư có nguồn gốc từ sinh vật biển đã được thương mại hóa. Các nghiên cứu khám phá ra rằng khả năng chống ung thư của Trabectedin nhờ vào sự kết hợp của nhiều cơ chế khác nhau. Trabectedin bám vào DNA làm thay đổi cấu trúc của DNA thông qua đó bất hoạt một số chức năng sinh học của DNA. Trabectedin có 3 tiểu đơn vị, trong đó 2 tiểu đơn vị liên kết với DNA. Sự có mặt Trabectedin làm thay đổi cấu trúc tự nhiên của DNA, uốn cong DNA theo hướng của các rãnh lớn. Một tiểu đơn vị tự do còn lại của Trabectedin nhô ra từ rãnh nhỏ DNA, tác động đến quá trình phiên mã thông qua ảnh hưởng lên quá trình bám protein lên DNA (38). Đặc biệt, Trabectedin còn ức chế mạnh mẽ hoạt động của nhân tố phiên mã NF-Y (Nuclear Factor Y Subunit Alpha), có vai trò quan trọng khởi động sự phiên mã các đoạn gen khác nhau điều khiển chu kỳ tế bào (39). Tracbectedin khóa chương trình sửa chữa DNA của tế bào. Một mục tiêu khác của Trabectedin là quá trình TC-NER (Transcription-Coupled Nucleotide Excision Repair), quá trình sửa chữa DNA tự động của tế bào. XPG là protein có chức năng sửa chữa DNA trong quá trình TC-NER. Trabectedin ngăn cản quá trình sửa chữa DNA đi xa hơn bằng cách “bẫy” dạng phức hợp XPG và DNA, gây ra sự phá hủy DNA (40, 41, 42, 43). Trabectedin ảnh hưởng tới quá trình phiên mã trong tế bào ung thư. Cấu trúc DNA thay đổi gây ra bởi Trabectedin làm sai lệch quá trình nhận diện trình tự DNA của các nhân tố phiên mã (44). Ở mức độ tế bào, Trabectedin dường như không ảnh hưởng đến các nhân tố liên quan đến quá trình phiên mã mà nó chỉ tác động lên quá trình phiên mã các gen hoạt động. Ở nồng độ nanomol, Trabectedin khóa sự phiên mã của các gen như HSP-70 (45) và MDR1 (46). Các nghiên cứu chỉ ra rằng Trabectedin không chỉ đính vào các rãnh của DNA, nó còn có khả năng ảnh hưởng đến các protein khởi động (promoter) liên quan đến các nhân tố phiên mã bám lên các rãnh chính của DNA. Ngoài ra, kết quả nghiên cứu xa hơn chỉ ra rằng Trabectedin không tác dụng trên tất cả các gen hoạt động. Trabectedin có thể ngăn cản quá trình phiên mã DHFR, TK và cyclin B2 nhưng kích thích quá trình phiên mã cyclin E (47, 48, 49). Thêm vào đó, Trabectedin có thể gây ra sự tăng hoặc giảm hoạt động của cùng một đoạn gen trên những dòng tế bào khác nhau. Các báo cáo đề nghị rằng các nhân tố liên quan đến quá trình phiên mã (co-factors) đặc trưng đối với từng dòng tế bào đóng vai trò quan trọng trong khả năng điều khiển quá trình phiên mã của Trabectedin (50). Vấn đề này vẫn đang được nghiên cứu sâu hơn. Trabectedin làm thay đổi môi trường tại khối u. Nó ức chế sự sản xuất một vài sản phẩm đặc trưng tại khối u bao gồm chất trung gian gây ra sự viêm nhiễm như CCL2, CXCL8, IL-6, các nhân tố làm tăng trưởng mạch máu nội mô (VEGF), protein PTX3, một số loại protein đặc trưng tại các dòng tế bào sacoma mỡ dạng niêm dịch và các mô tế bào sacoma mỡ dạng niêm dịch trên chuột bệnh (51). |
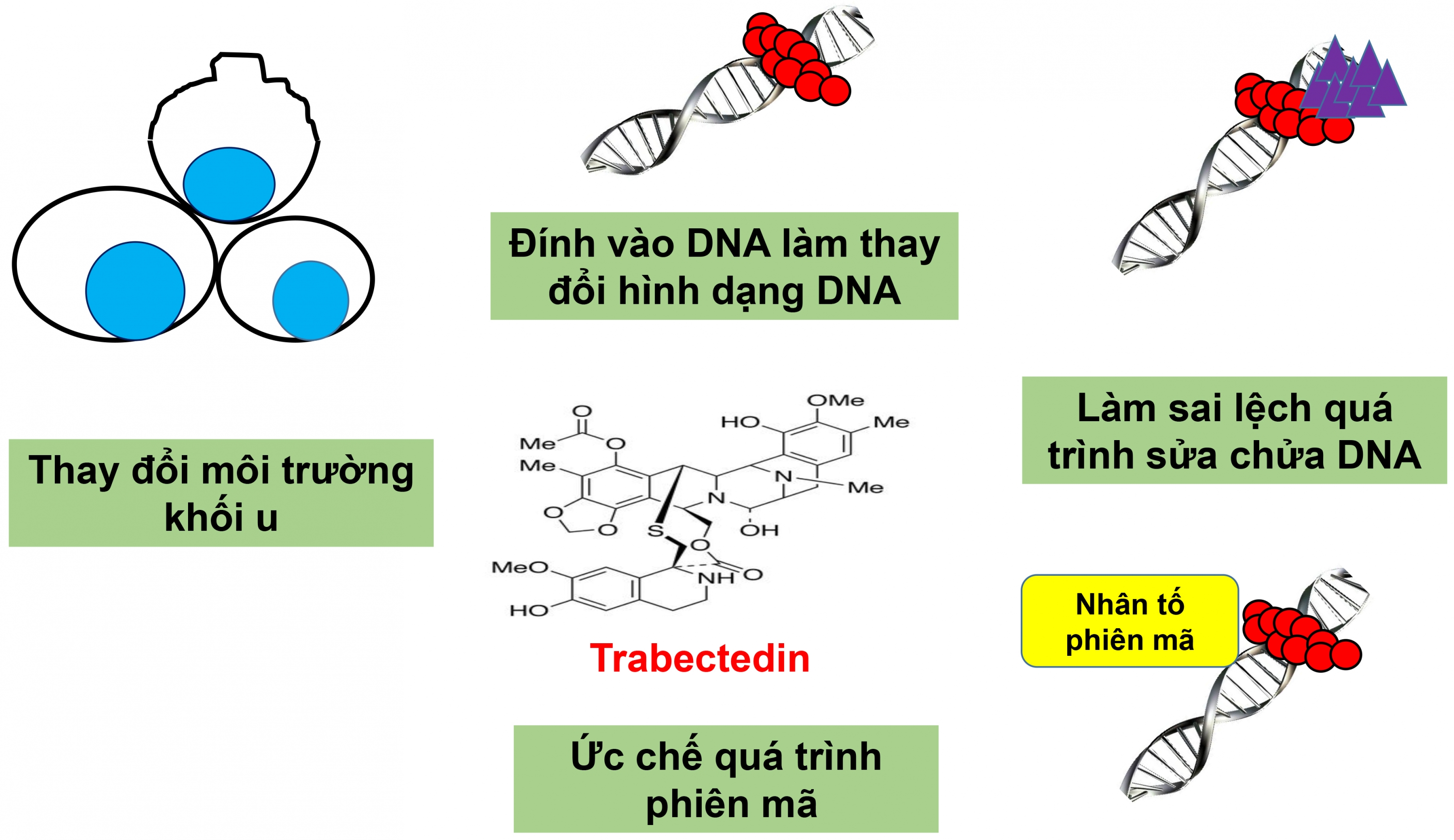
Hình 3: Cơ chế tác dụng của Trabectedin lên tế bào ung thư. Độc tính của Trabectedin được gây ra bởi sự tổ hợp nhiều cơ chế khác nhau. Trabectedin bám vào DNA làm thay đổi hình dạng của DNA khiến DNA không thể thực hiện các chức năng sinh học của nó. Mặt khác, Trabectedin ngăn cản quá trình sửa chữa DNA (TC-NER). Thêm vào đó, Trabectedin ức chế quá trình phiên mã thông qua việc điều khiển các nhân tố liên quan đến quá trình phiên mã đặc trưng bởi từng tế bào. Trabectedin còn gây ra những thay đổi môi trường tại khối u.
Thách thức đối với nghiên cứu hợp chất thiên nhiên trong hóa trị
Một thực tế, việc thu thập nguyên liệu phục vụ nghiên cứu và phát triển sản xuất trên quy mô công nghiệp các dược chất có nguồn gốc thiên nhiên thường gây ra tác động xấu đối với môi trường. Để khắc phục nhược điểm này, hợp chất có nguồn gốc thiên nhiên thường được tổng hợp hoặc bán tổng hợp sau khi chứng minh các hơp chất này có khả năng tiêu diệt tế bào ung thư. Một con đường khác thường được sử dụng là thay thế nguyên liệu khó thu thập (các loại cây mọc ở vùng núi, hay sinh vật biển) bằng các nguyên liệu dễ tìm, có thể nuôi trồng trên quy mô công nghiệp nhưng chứa hợp chất có cấu trúc giống nhau hoặc có chứa các tiền chất của hợp chất chống ung thư sau đó tiến hành bán tổng hợp. Một ví dụ tiêu biểu là Taxol. Từ năm 1967 đến 1993, hầu như tất cả Taxol được sản xuất bằng cách phân lập từ vỏ cây Thông đỏ, một số lượng lớn cây Thông đỏ đã bị tiêu diệt để phục vụ nghiên cứu. Năm 1969, 28 kg dịch chiết thô được chiết tách từ 12000 kg vỏ, cuối cùng chỉ thu nhận được 10 gram nguyên liệu Taxol sạch. Bởi vì sự khó khăn trong việc tập hợp nguyên liệu và sự phức tạp trong quá trình tổng hợp Taxol, việc phát triển nghiên cứu lâm sàng Taxol tiến hành rất chậm. Các thử nghiệm lâm sàng Taxol chỉ có khả năng tiến hành sau khi các nhà khoa học tìm ra phương pháp bán tổng hợp Taxol. Để giải quyết vấn đề này, một con đường mới để sản xuất Taxol được phát triển. Tiền chất của Taxol, 10-deacetyl-baccatin III, được phân lập từ Taxus baccata (một loài Thông thường được trồng trong vườn nhà). Loài Thông này cùng chi Thông (Taxus) với Taxus brevifolia (cây Thông đỏ), nhưng dễ trồng, có thể phát triển số lượng lớn trong điều kiện nhân tạo. Tiền chất này được chuyển đổi thành Taxol bằng các phương pháp hóa học. Hiện nay, một phương pháp nuôi cấy tế bào được phát triển bởi Phyton Catalytic được Bristol-Myers Squibb (BMS) sử dụng để sản xuất Taxol (52).
Quá trình nghiên cứu, phát triển hợp chất thiên nhiên trong điều trị ung thư là một quá trình dài từ 15 đến 20 năm, cần nguồn kinh phí lớn. Từ 10000 đến 15000 hợp chất thiên nhiên trải qua quá trình đánh giá hoạt tính sinh học, thường chỉ có khoảng 250 hợp chất đủ điều kiện tham gia vào quá trình đánh giá Tiền lâm sàng (Preclinical). Sau quá trình này, chỉ có khoảng 5 hợp chất đủ điều kiện tham gia vào các Thử nghiệm lâm sàng pha I, pha II, pha III. Cuối cùng, chỉ duy nhất một hợp chất được FDA công nhận, cho phép sử dụng trong điều trị. Toàn bộ quá trình này tiêu tốn khoảng một tỷ đô la Mỹ (53).
Tại Việt Nam, mặc dù chúng ta có nguồn lợi thiên nhiên vô cùng phong phú nhưng do thiếu thốn về thiết bị nghiên cứu, các chuyên gia đầu ngành trong nghiên cứu sàng lọc các hợp chất có hoạt tính có nguồn gốc thiên nhiên, cũng như tiến hành nghiên cứu về cơ chế tương tác giữa thuốc và tế bào ung thư nên việc khai thác những nguồn lợi này còn nhiều hạn chế.
Kết luận
Các hợp chất thiên nhiên và các hợp chất dẫn xuất có cấu trúc liên quan vẫn chiếm 50% số lượng thuốc đang được sử dụng trong hoá trị ung thư (54). Điều này cho thấy hợp chất thiên nhiên vẫn là nguồn nguyên liệu chính để tìm kiếm các hợp chất có độc tính trên tế bào ung thư. Bên cạnh các hợp chất thiên nhiên được sử dụng trong hóa trị ung thư, hợp chất thiên nhiên được sử dụng trong ngăn ngừa ung thư cũng là một hướng được quan tâm. Khí hậu và điều kiện thổ nhưỡng Việt Nam thích hợp cho sự phát triển của nhiều loại thảo dược quý, tuy nhiên những nghiên cứu về hợp chất thiên nhiên vẫn còn nhiều hạn chế về quy mô lẫn chiều sâu. Để khai thác được nguồn dược liệu quý giá mà thiên nhiên trao tặng cho Việt Nam cần có một sự đầu tư đúng đắn về thiết bị, con người, chuyển giao công nghệ cũng như hợp tác nghiên cứu.
Về tác giả:
Trần Thị Hồng Loan hiện đang là Nghiên Cứu sinh theo học chương trình Tiến sĩ tại Viện Nghiên cứu Hợp chất Thiên nhiên, Đại học Y Cao Hùng, Đài Loan; Trợ lý nghiên cứu bán thời gian tại Trung tâm Nghiên cứu Bệnh Truyền nhiễm và Ung thư, Đại học Y Cao Hùng, Đài Loan.
Nguyễn Minh Hiền hiện đang là giảng viên tại Khoa Hoá, Đại học Sư phạm, Đại học Đà Nẵng. Nguyễn Minh Hiền tốt nghiệp Tiến sĩ chuyên ngành Sinh hoá hữu cơ tại Đại học Osaka, Osaka, Nhật Bản.
Biên tập viên: Nguyễn Phi Minh
Tài liệu tham khảo
- NHÓM ĐỐI TÁC Y TẾ (2016) BÁO CÁO CHUNG TỔNG QUAN NGÀNH Y TẾ NĂM 2015 (NHÀ XUẤT BẢN Y HỌC), pp 20.
- Mann J (2002) Natural products in cancer chemotherapy: past, present and future. Nature Reviews 2 (2): 143 - 148.
- Đỗ Tất Lợi (2004) Những cây thuốc và vị thuốc Việt Nam. Nhà xuất bản Y học (XII), pp 307-309.
- Zubrod C G (1984) Origins and development of chemotherapy research at the National Cancer Institute. Cancer Treat 68 (1): 9–19.
- Watson R R, Zibadi S, Preedy V R (2010) Dietary Components and Immune Function. (Human Press), pp 323-324.
- Jonathan L. Hartwell (1982) Plants Used Against Cancer (Quarterman Pub).
- Altmann K H, Gertsch J (2007) Anticancer drugs from nature-natural products as a unique source of new microtubule-stabilizing agents. Natural Products Reports 24(2): 327-357.
- Lee K H (1999) Anticancer drug design based on plant-derived natural products. Journal of Biomedical Science 6(4): 236-250.
- Taxol® (NSC125973). https://dtp.cancer.gov/timeline/flash/success_stories/S2_taxol.htm
- McLeod H (2005) Cancer clinical pharmacology, eds Schellens J H M, McLeod H L, Newell D R (Oxford University Press), pp 104–16.
- Gueritte-Voegelein F, et al (1991) Relationships between the structure of Taxol analogues and their antimitotic activity. Journal of Medicinal Chemistry 34(3): 992–998.
- Wall M. E, et al (1966) Plant Antitumor Agents. I. The Isolation and Structure of Camptothecin, a Novel Alkaloidal Leukemia and Tumor Inhibitor from Camptotheca acuminata. Journal of the American Chemical Society 88(16): 3888-3890.
- Galsky M D, Dritselis A, Kirkpatrick P, Oh W K (2010) Cabazitaxel. Nat. Rev. Drug Discov. 9(9): 677–678.
- Kantarjian H M, O’Brien S, and Cortes J (2013) Homoharringtonine/Omacetaxine mepesuccinate: the long and winding oad to food and drug administration approval. Clin. Lymphoma Myeloma Leuk. 13(5), 530–533.
- Siller G, Gebauer K, Welburn P, Katsamas J, and Ogbourne S M (2009) PEP005 (ingenol mebutate) gel, a novel agent for the treatment of actinic keratosis: results of a randomized, double-blind, vehicle-controlled, multicen- tre, phase IIa study. Australas. J. Dermatol. 50(1), 16–22.
- Jordan M A, Wilson L (2004) Microtulube as a target for anticancer drugs. Nature Reviews Cancer 4(4): 253-265.
- Thayer A (2010) More than a supplier. Chem Eng News 88(11): 25–27
- Arcamone F, Cassinelli G, Fantini G, et al (1969) Adriamycin, 14-hydroxydaunomycin, a new antitumor antibiotic from S. peucetius var. caesius. Biotechnology and Bioengineering 11 (6): 1101–1110.
- Di Marco A, Gaetani M, Scarpinato B (1969) Adriamycin (NSC-123,127): a new antibiotic with antitumor activity. Cancer Chemother 53 (1): 33–7.
- Hoefle, G., Bedorf, N., Gerth, K., and Reichenback, H. Patent DE 4138042, 1993
- FDA Approval for Ixabepilone, https://www.cancer.gov/about-cancer/treatment/drugs/fda-ixabepilone
- Bergmann W, Feeney R J (1950) The isolation of a new thymine pentoside from sponges1. Journal of American Chemical Society 72(6): 2809–2810.
- Tadeusz F. Molinski, Doralyn S. Dalisay, Sarah L. Lievens, Jonel P. Saludes (2009) Drug development from marine natural products. Nature Reviews Drug Discovery (8): 69-85
- Newman D J, Cragg G M (2012) Natural products as sources of new drugs over the 30 years from 1981 to 2010. Journal of Natural Products 75(3): 311–335.
- Nastrucci C, Cesario A, Russo P (2012) Anticancer drug discovery from the marine environment. Recent Patents Anticancer Drug Discovery 7(2): 218–232.
- Sarfaraj H M, Sheeba F, Saba S, Mohd. Sajid K (2012) Marine Natural products: A lead for Anti-cancer. Indian Journal of Geo-Marine Sciences 41(1): 27-39.
- Arnold L. D (2011) Natural products for cancer chemotherapy. Microbial Biotechnology 4(6): 687–699.
- FDA Approval for Eribulin Mesylate. https://www.cancer.gov/aboutcancer/treatment/drugs/fda-eribulinmesylate
- Cortes J, Montero A J, Gluck S (2012) Eribulin mesylate, a novel microtubule inhibitor in the treatment of breast cancer Cancer Treat Rev. 38(2): 143-151.
- Barboza N M, Medina D J, Budak T-A, Aracil M, Jimeno J M, Bertino J R, Banerjee D (2012) Plitidepsin (Aplidin) is a potent inhibitor of diffuse large cell and Burkitt lymphoma and is synergistic with rituximab. Cancer Biol. Ther. 13(2): 114-122.
- Singh A V, Bandi M, Raje N, Richardson P, Palladino M A, Chauhan D, Anderson K C (2011) A novel vascular disrupting agent plinabulin triggers JNK-mediated apoptosis and inhibits angiogenesis in multiple myeloma cells. Blood 117(21): 5692-5700.
- Arnold L Demain and Sergio Sanchez (2009) Microbial drug discovery: 80 years of progress. The Journal of Antibiotics 62: 5–16.
- Tan C, Tasaka H, Yu KP, Murphy ML, Karnofsky DA (1967) Daunomycin, an antitumor antibiotic, in the treatment of neoplastic disease. Clinical evaluation with special reference to childhood leukemia. Cancer 20(3): 333–53.
- Caroline F. Thorna, Connie Oshiroa, Sharon Marshe, et. al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics 21(7): 440–446.
- Tacara O, Sriamornsak P, Dass C R (2012) Doxorubicin: an update on anticancer molecular action, toxicity and novel drug delivery systems. The Journal of Pharmacy and Pharmacology 65(2): 157-170
- Chen M B, et al (2011) Activation of AMPactivated protein kinase is involved in vincristine-induced cell apoptosis in B16 melanoma cell. Journal of Cellular Physiology 226(7): 1915–1925.
- Harris C C, Hollstein M (1993) Clinical Implications of the p53 Tumor-Suppressor Gene. The New England Journal of Medicine 329(18): 1318-1327.
- Kim S K (2015) Handbook of antican drugs from marine orgin (Springer) pp 397-412.
- Fayette J, Coquard I R, Alberti L, Ranchère D, Boyle H, Blay J Y (2005) ET-743: a novel agent with activity in soft tissue sarcomas. Oncologist 10(10):827–832.
- Sima P, Vetvicka V (2011) Bioactive substances with anti-neoplastic efficacy from marine invertebrates: Bryozoa, Mollusca, Echinodermata and Urochordata. World Journal of Clinical Oncology 2(11): 362-366.
- Tohme R, Darwiche N, Gali-Muhtasib H (2011) A journey under the sea: the quest for marine anti-cancer alkaloids. Molecules 16(12): 9665–9696.
- Mayer A(2013) Marine pharmaceuticals: the preclinical pipeline. http://marinepharmacology.midwestern.edu/preclinPipeline.htm. Accessed 15 Oct 2013
- Tulp M, Bohlin L (2002) Functional versus chemical diversity: is biodiversity important for drug discovery. Trends Pharmacology Science 23(5): 225–231.
- Bonfanti M, La Valle E, Fernandez Sousa Faro J M, Faircloth G, Caretti G, D'Incalci M (1999) Effect of ecteinascidin-743 on the interaction between DNA binding proteins and DNA. Anticancer Drug Design 14(3): 179–186.
- Minuzzo M, Marchini S, Broggini M, Faircloth G, D'Incalci M, Mantovani R (2000) Interference of transcriptional activation by the antineoplastic drug ecteinascidin-743. Proceeding National Academy of Science of United States of America 97(12): 6780–6784.
- Jin S, Gorfajn B, Faircloth G, Scotto K W (2000) Ecteinascidin 743, a transcription-targeted chemotherapeutic that inhibits MDR1 activation Proceeding National Academy of Science of United States of America 2000 97(12): 6775–6779.
- Friedman D, Hu Z, Kolb E A, Gorfajn B, Scotto K W (2002) Ecteinascidin-743 inhibits activated but not constitutive transcription. Cancer Research 62(12): 3377– 3381.
- Minuzzo M, Ceribelli M, Pitarque-Marti M, et al (2005) Selective effects of the anticancer drug Yondelis (ET-743) on cell-cycle promoters. Molecular Pharmacol 68(5):1496–1503.
- Aune G J, Takagi K, Sordet O, et al (2008) Von Hippel-Lindau-coupled and transcription-coupled nucleotide excision repair-dependent degradation of RNA polymerase II in response to trabectedin. Clinical Cancer Research 14(20): 6449–6455.
- Maurizio D'Incalci and Carlos M. Galmarini, (2010), A Review of Trabectedin (ET-743): A Unique Mechanism of Action, http://mct.aacrjournals.org/content/9/8/2157
- Germano G, Frapolli R, Simone M, et al (2010) Antitumor and antiinflammatory effects of trabectedin on human myxoid liposarcoma cells. Cancer Research 70(6): 2235–2244.
- A Story of Discovery: Natural Compound Helps Treat Breast and Ovarian Cancers . https://www.cancer.gov/research/progress/discovery/taxol
- About Drug Development http://www.ppdi.com/About/About-Drug-Discovery-and-Development
- Natural Product Shows Effectiveness in Combating Colorectal Cancer. https://ncifrederick.cancer.gov/about/theposter/content/natural-product-shows-effectiveness-combating-colorectal-cancer