Lê Hoàng1 *
1 Trung tâm nghiên cứu thần kinh-mạch máu SNU-Harvard, Khoa Dược, Đại học Quốc gia Seoul, Hàn Quốc.
* Độc giả có thắc mắc về bài báo xin liên hệ lehoang306@snu.ac.kr
Giới thiệu
Kỹ thuật optogenetics (Opto = quang; genetic = di truyền) được tạp chí danh tiếng Nature Methods chọn là phương pháp của năm 2010 với tiềm năng to lớn trong nghiên cứu thần kinh và các quá trình sinh học (1). Kỹ thuật này bắt nguồn từ việc sử dụng các protein cảm ứng ánh sáng channelrhodopsin-2 có trong tảo xanh để điều khiển hoạt động của nơron (tế bào thần kinh có chức năng dẫn truyền xung điện). Trải qua một thập kỷ nghiên cứu, các nhà khoa học đã sử dụng kỹ thuật này để khám phá ra nhiều thông tin quan trọng trong thần kinh học và các quá trình sinh học trong tế bào sống. Trong bài báo này, chúng tôi cung cấp cho độc giả những những thông tin mới nhất về kỹ thuật optogenetics và tiềm năng ứng dụng trong nghiên cứu Y Sinh học.
Lịch sử phát triển
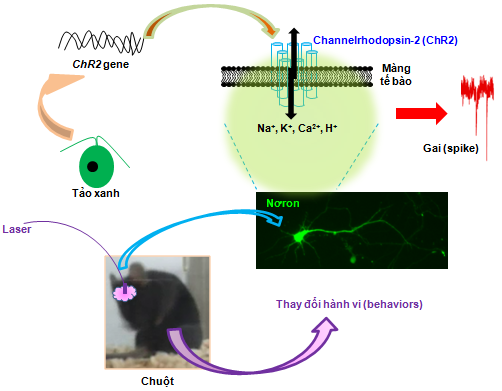
Sử dụng ánh sáng để điều khiển hoạt động của nơron đã được chứng minh tại phòng thí nghiệm của giáo sư Gero Miesenböck ở Đại học Yale (Mỹ) trong những năm đầu của thế kỷ 21. Nhóm nghiên cứu đã dùng các chủng ruồi giấm (Drosophila melanogaster) biến đổi gene mã hóa các kênh ion đáp ứng với ánh sáng (light-gated ion channels) như rhodopsin, TRPV1, TRPM8 và P2X2 (2, 3). Tuy nhiên, kỹ thuật này phức tạp và khó thực hiện nên không có phòng thí nghiệm nào khác áp dụng. Cuối năm 2003, giáo sư Ernst Bamberg và Georg Nagel thuộc Viện Max Planck (Đức) công bố việc tìm ra tính chất quan trọng của channelrhodopsin-2 (ChR2), một kênh dẫn ion tự nhiên cảm ứng với ánh sáng có trong tảo xanh (Chlamydomonas reinhardtii). Khi protein này biểu hiện trong trứng ếch (Xenopus laevis) và tế bào động vật có vú, kênh channelrhodopsin-2 đóng hay mở phụ thuộc vào ánh sáng chiếu vào hay tắt đi (4). Vào năm 2005, tạp chí uy tín trong lĩnh vực thần kinh Nature Neuroscience công bố một phát minh mang tính cột mốc, là tiền đề đánh dấu cho sự ra đời của một lĩnh vực mới sau đó 2 năm (5). Công trình nghiên cứu này do tiến sỹ Edward S Boyden, Feng Zhang, và giáo sư Karl Deisseroth tại Đại học Standford (Mỹ) hợp tác với nhóm nghiên cứu của giáo sư Ernst Bamberg và Georg Nagel thực hiện. Các nhà khoa học đã dùng ánh sáng để điều khiển hoạt động của nơron nuôi cấy từ vùng hải mã (hippocampus) của chuột chính xác đến mili giây (ms) bằng cách biến nạp channelrhodopsin-2 vào nơron rồi dùng ánh sáng xanh chiếu vào. Khi nhận ánh sáng, channelrhodopsin-2 trong nơron mở kênh cho các ion như Na+, K+, Ca2+, và H+ đi qua, tạo ra điện thế hoạt động (action potential, thể hiện bằng các gai nhọn (spikes) trên hình ảnh ghi lại (recording)), do đó thúc đẩy quá trình truyền tín hiệu giữa các nơron. Mặc dù đây là một phát minh thú vị, nhưng không phải nhà khoa học nào cũng đánh giá cao bởi vì thí nghiệm này chỉ tiến hành trên nơron trong đĩa nuôi cấy (điều kiện in vitro), họ chưa nhìn thấy tiềm năng của kỹ thuật này trên in vivo. Tuy nhiên, nhóm nghiên cứu của giáo sư Gottschalk ở Đại học Frankfurt (Đức) sau đó đã chứng minh họ có thể thay đổi hành vi (behaviors) của giun tròn (Caenorhabditis elegans) mang channelrhodopsin-2 thông qua ánh sáng chiếu vào (6). Bên cạnh đó, sau 2 năm tiếp theo kiên trì thử nghiệm, cuối cùng nhóm nghiên cứu của giáo sư Karl Deisseroth đã thành công trong việc điều khiển hoạt động của nơron trên não chuột trong điều kiện chuột vẫn đang di chuyển tự do (7, 8). Nhóm nghiên cứu đã đặt tên cho kỹ thuật là optogenetics, nghĩa là dùng ánh sáng để điều khiển hoạt động của gene trong tế bào của cơ thể động vật còn sống (điều kiện in vivo). Các nhà khoa học đã thực sự bị thuyết phục bởi tiềm năng to lớn của kỹ thuật này, nhiều phòng thí nghiệm ở khắp nơi trên thế giới đang tích cực nghiên cứu các quá trình sinh học thông qua việc sử dụng kỹ thuật optogenetics.
Hệ thống optogenetics
Để có thể điều khiển hoạt động của các tế bào sống trong một cơ thể động vật sống, ví dụ tế bào nơron trong não chuột, hệ thống optogenetics cần có chất cảm ứng ánh sáng (ví dụ channelrhodopsin-2 của tảo xanh và các dẫn chất) và nguồn ánh sáng laser với các bước sóng khác nhau phù hợp với chất cảm ứng ánh sáng (9). Gene mã hóa chất cảm ứng ánh sáng được biến nạp vào tế bào nhận, ví dụ nơron, phổ biến nhất là thông qua virus an toàn với sinh vật nghiên cứu. Ngoài ra, để đưa ánh sáng đến được với chất cảm ứng ánh sáng trong các nơron nằm sâu bên trong não động vật, các nhà khoa học cần phải dùng thêm dây cáp quang (optic fiber) có một đầu gắn vào sọ não (Hình 1).
Hình 1. Minh họa hệ thống optogenetics
Ứng dụng và triển vọng tương lai
Mặc dù mới ra đời được một thập kỷ (từ năm 2005) nhưng kỹ thuật optogenetics đã mở ra một kỷ nguyên mới trong nghiên cứu sinh học nói chung và khoa học thần kinh nói riêng. Theo giáo sư Karl Deisseroth, hiện nay có hơn 1000 phòng thí nghiệm trên thế giới đang sử dụng kỹ thuật optogenetics để nghiên cứu trong nhiều lĩnh vực, sử dụng nhiều mô hình động vật khác nhau như cá ngựa vằn (zebrafish), giun tròn, chuột, khỉ,…(10).
Khoa học thần kinh. Ước mơ của các nhà nghiên cứu thần kinh đó là có thể hiểu hết được chức năng và cơ chế hoạt động của các nơron trong não, đặc biệt là cách chúng truyền tín hiệu theo một hệ thống mạch (circuit). Công nghệ optogenetics cho phép các nhà khoa học nghiên cứu được hoạt động của một nhóm nơron trong bộ não còn nguyên vẹn của một cơ thể sinh vật vẫn đang sống và di chuyển. Sử dụng kỹ thuật này, các nhà khoa học đã tìm ra nhiều vùng quan trọng đặc hiệu trong não đóng vai trò trong sinh lý học não bộ và hành vi của động vật như đói, khát, ngủ, vận động,… (9, 11), thậm chí dùng nó để tăng hoặc xóa ký ức của chuột (12, 13). Mặc dù đã có rất nhiều tiến bộ khoa học trong lĩnh vực thần kinh, nhưng bộ não vẫn là một trong những cơ quan phức tạp và bí ẩn nhất đòi hỏi chúng ta phải tiếp tục nghiên cứu. Đó cũng là lý do mà Mỹ và Châu Âu đã độc lập đưa ra hai dự án khổng lồ với kinh phí hàng tỷ đô la để giải mã bộ não người. Mỹ tiến hành dự án BRAIN (Brain Research through Advancing Innovative Neurotechnologies, nghiên cứu não bộ thông qua các tiến bộ công nghệ mới) từ đầu năm 2013 (14), trong khi Châu Âu thực hiện Human Brain Project (dự án giải mã não bộ người) bắt đầu từ cuối năm 2013 (15), giống như dự án giải mã trình tự bộ gene người (Human Genome Project) ở thập kỷ trước. Sử dụng kỹ thuật optogenetics chắc chắn sẽ giúp các nhà khoa học vén được nhiều hơn nữa những bức màn bí mật trong thần kinh học.
Sinh học tế bào. Nhiều phòng thí nghiệm trên thế giới đã thành công trong việc sử dụng kỹ thuật optogenetics để điều khiển nhiều hoạt động trong tế bào sống, như khu trú protein tại một vùng, sản xuất chất truyền tin thứ hai, và các con đường truyền tín hiệu trong tế bào, đóng góp lớn vào hiểu biết của chúng ta về sinh học tế bào (16).
Y học. Optogenetics đã giúp các nhà khoa học khám phá ra nhiều cơ chế gây ra bệnh thần kinh, ví dụ bệnh tự kỷ, trầm cảm, rối loạn ám ảnh cưỡng chế (OCD), động kinh, nghiện cocain,…(11, 17). Đây là những bệnh rất phức tạp do sự tác động tổng hợp của nhiều khiếm khuyết (defects) ở nhiều vùng và tế bào trong não bộ, muốn tìm hiểu cơ chế bệnh để từ đó tìm ra liệu pháp điều trị đòi hỏi phải kết hợp nhiều công nghệ, trong đó có optogenetics (để nghiên cứu trên mô hình động vật). Bên cạnh đó, với sự tiến bộ mạnh mẽ của khoa học kỹ thuật, trong tương lai gần chúng ta hoàn toàn có thể biến nạp các protein cảm nhận ánh sáng vào trong não người thông qua các virus an toàn rồi sau đó kích thích các nơron hoạt động để tăng dẫn truyền, giúp điều trị các bệnh có dẫn truyền thần kinh kém. Ví dụ, vào tháng 3 năm 2016, công ty RetroSense Therapeutics (Michigan, Mỹ) đã bắt đầu thử nghiệm lâm sàng (clinical trial) đầu tiên trên thế giới để đánh giá độ an toàn và hiệu quả của liệu pháp optogenetics trong điều trị 15 bệnh nhân bị viêm võng mạc sắc tố (retinitis pigmentosa, đây là bệnh do nơron nhạy cảm ánh sáng trong võng mạc thoái hóa, cuối cùng gây mù mắt) (18).
Cải tiến của kỹ thuật optogenetics
Nhằm khắc phục một trong những nhược điểm của kỹ thuật optogenetics đó là cần phải trải qua quy trình phẫu thuật xâm lấn (invasive procedures) để đưa nguồn ánh sáng vào trong não thông qua dây dẫn, nhóm nghiên cứu do tiến sĩ Stuart Ibsen và giáo sư Sreekanth H. Chalasani thuộc viện nghiên cứu sinh học Salk (Mỹ) đã phát minh ra kỹ thuật Sonogenetic (Sono = sóng âm; genetic = di truyền) (19). Họ đã thành công trong việc sử dụng sóng siêu âm để điều khiển hoạt động của nơron vận động trong giun tròn Caenorhabditis elegans. Công nghệ này mở ra triển vọng có thể thay thế kỹ thuật kích thích não sâu (deep brain stimulation; thông qua điện cực nhúng xuyên sâu vào trong não) dùng trong điều trị bệnh trầm cảm và bệnh Parkinson trong tương lai gần.
Gần đây nhất, vào cuối năm 2015, một nhóm các nhà khoa học tại đại học Illinois và Washington (Mỹ) đã công bố trên tạp chí Nature Biotechnology một cải tiến mới của kỹ thuật optogenetics gọi là Wireless optogenetics (20). Kỹ thuật này cho phép các nhà khoa học điều khiển hoạt động của nơron tủy sống (spinal cord) và ngoại biên của chuột từ xa thông qua sóng wifi, không cần dây cáp quang nữa. Đây là phát minh hứa hẹn mang lại tiềm năng ứng dụng lớn trong Y học.
Các nhà khoa học vẫn đang tiếp tục tối ưu hóa hệ thống optogenetics và tạo ra các cải tiến mới để khắc phục những yếu điểm và bổ sung thêm các tiện ích cho công nghệ này để optogenetics có thể áp dụng rộng rãi, dễ dàng, giảm chi phí và an toàn.
Kết luận
Kỹ thuật optogenetics đã mở ra một lĩnh vực mới thu hút sự quan tâm rộng rãi của các nhà khoa học trong nhiều lĩnh vực từ khắp nơi trên thế giới. Số lượng nghiên cứu công bố trên các tạp chí, đặc biệt là các tạp chí uy tín ngày càng tăng là minh chứng rõ rệt cho tính ứng dụng cao của kỹ thuật này. Với sự phát triển mạnh mẽ của công nghệ optogenetics, chúng ta hoàn toàn có thể hi vọng vào một ngày không xa kỹ thuật này sẽ được sử dụng trong điều trị nhiều bệnh như viêm võng mạc sắc tố, đau thần kinh mãn tính, liệt tủy, đột quỵ, bệnh Parkinson, trầm cảm,...Kỹ thuật optogenetics lại một lần nữa chứng tỏ phát minh lớn hoàn toàn có thể đến từ những nghiên cứu về sinh vật đơn giản như tảo và vi khuẩn. Cùng với CRISPR-cas9 trong chỉnh sửa bộ gene, optogenetics là một trong hai công nghệ có tiềm năng ứng dụng lớn nhất trong mười năm trở lại đây trong lĩnh vực Y Sinh học.
Về tác giả: Lê Hoàng hiện đang là nghiên cứu sinh tại trung tâm nghiên cứu thần kinh-mạch máu SNU-Harvard, Khoa Dược, Đại học Quốc gia Seoul, Hàn Quốc.
Biên tập viên: Đàm Xuân Thái
Tài liệu tham khảo
- Editorial, Method of the Year 2010. Nat Methods, 2011. 8: p.1.
- Miesenböck G, Genetic methods for illuminating the function of neural circuits. Curr Opin Neurobiol, 2004. 14(3):395-402.
- Lima SQ & Miesenböck G, Remote control of behavior through genetically targeted photostimulation of neurons. Cell, 2005. 121(1): p.141-52.
- Nagel G et al, Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci USA, 2003. 100(24): p13940-45.
- Boyden ES, Zhang F, Bamberg E, Nagel G & Deisseroth K, Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci, 2005. 8: p.1263-68.
- Nagel G et al., Light activation of channelrhodopsin-2 in excitable cells of Caenorhabditis elegans triggers rapid behavioral responses. Curr Biol., 2005. 15(24): p.2279-84.
- Aravanis AM et al, An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. J. Neural Eng., 2007. 4: p.S143-S156.
- Adamantidis AR et al, Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature, 2007. 450: 420-24.
- Karl Deisseroth, Optogenetics: 10 years of microbial opsins in neuroscience. Nat Neurosci, 2015. 18: p.1213-25.
- Adamantidis AR et al, Optogenetics: 10 years after ChR2 in neurons-views from the community. Nat Neurosci, 2015. 18(9): p.1202-12.
- Rajasethupathy P, Ferenczi E & Deisseroth K, Targeting Neural Circuits. Cell, 2016. 165(3): p.524-34.
- Liu X et al, Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature, 2012. 484: p.381-85.
- Ramirez S et al, Creating a False Memory in the Hippocampus. Science, 2013. 341: p.387-91.
- Helen Shen, Neurotechnology: BRAIN storm. Nature, 2013. p.26-28.
- Kai Kupferschmidt, Graphene and Brain Projects Win European Jackpot. Science, 2013. 339 (6119): p.497.
- Toettcher JE, Voigt CA, Weiner OD & Lim WA., The promise of optogenetics in cell biology: interrogating molecular circuits in space and time. Nat Methods, 2011. 8: p.35-38 (2011).
- Deisseroth K, Optogenetics and psychiatry: applications, challenges, and opportunities. Biol Psychiatry, 2012. 71(12): p.1030-32.
- Katherine B, In First Human Test of Optogenetics, Doctors Aim to Restore Sight to the Blind. MIT technology review, 2016. https://www.technologyreview.com/s/600696/in-first-human-test-of-optogenetics-doctors-aim-to-restore-sight-to-the-blind/ .
- Ibsen S, Tong A, Schutt C, Esener S & Chalasani SH. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nat Commun, 2015. 6 (article 8264): p.1-12.
- Park SI et al, Soft, stretchable, fully implantable miniaturized optoelectronic systems for wireless optogenetics. Nat Biotechnol, 2015. 33(12): p.1280-86.


