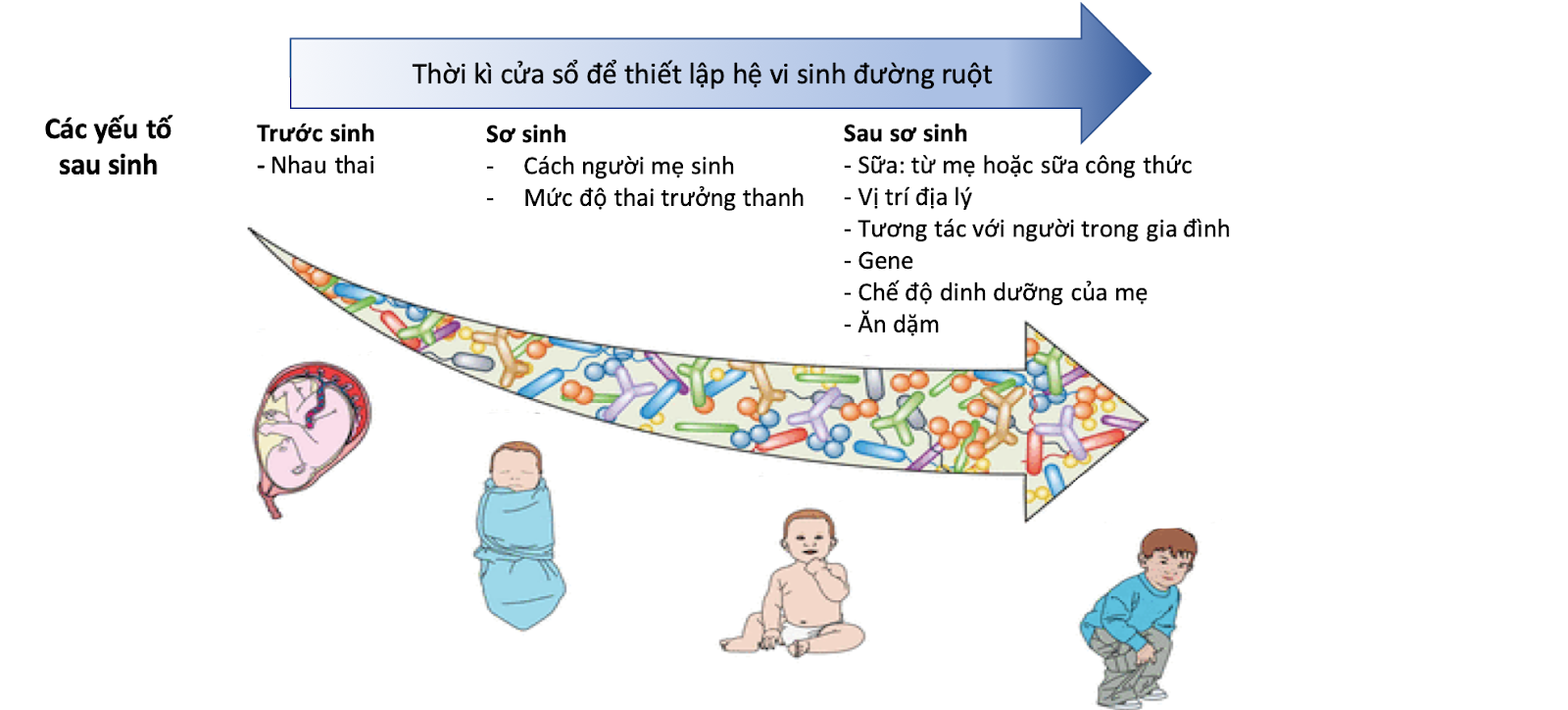
Như chúng ta đã biết ở phần trước, hệ vi sinh đường ruột là một hệ thống sinh thái phức tạp tạo nên bởi hàng triệu vi sinh bên trong. Chúng tương tác với vật chủ, bảo vệ vật chủ từ bên trong cũng như cung cấp một số lợi ích cho vật chủ. Vì vậy, hệ vi sinh đóng vai trò thực sự quan trọng với chúng ta, trong đó đặc biệt là trẻ nhỏ. Ở giai đoạn đầu đời, việc thiếu đi những lợi khuẩn thiết yếu sẽ ảnh hưởng đến sự hoàn thiện của hệ miễn dịch trẻ, như dễ có nguy cơ bệnh tự miễn về sau như hen suyễn, dị ứng hoặc tiểu đường. “Khoảng thời gian vài tuần đầu tiên trong đời là thời kì cửa sổ quan trọng nhất để hình thành hệ miễn dịch ở trẻ nhỏ, thứ sẽ ảnh hưởng đến cả sau này nhưng chúng ta biết khá ít về điều đó”, Giáo sư Peter Brocklehurst của ĐH Birmingham cho biết [1]. Cả quá trình này được chia thành ba giai đoạn chính bao gồm: giai đoạn trong bụng mẹ, giai đoạn sơ sinh, giai đoạn sau sơ sinh (nhỏ hơn 1 tuổi) với mỗi giai đoạn đều có một hoặc nhiều yếu tố tác động. Từ 36 tháng trở đi, hệ vi sinh vật ở trẻ dần ổn định hơn và tương tự người lớn [2].
Hình 1. Quá trình thiết lập và phát triển hệ vi sinh đường ruột từ thời kì mang thai đến khi trẻ được 3 tuổi. Giai đoạn này là thời kì cửa sổ để điều chỉnh hệ vi sinh đường ruột bao gồm các yếu tố trước khi sinh, sơ sinh, và sau sơ sinh (Milani et al.,2017)
1. Giai đoạn trong bụng mẹ
Việc vi sinh đã xâm lấn ở giai đoạn này hay không hiện nay vẫn còn đang là một vấn đề tranh cãi. Gần đây các nghiên cứu đã xác định quá trình xâm lấn bắt đầu tại thời điểm đứa bé được sinh ra. Việc một cá thể vô trùng nằm bên trong môi trường như tử cung người mẹ là khá lạ vì sự hiện diện của vi sinh ở nhau thai, dây rốn hoặc nước ối là khá bình thường [3-5]. Tuy đã có nhiều giả thuyết về khả năng vi sinh bắt đầu xâm nhập vào cơ thể trước khi đứa trẻ sinh ra nhưng vẫn chưa có bằng chứng cụ thể cho các giả thuyết này [6-8].
2. Giai đoạn sơ sinh
2.1 Mức độ hoàn thiện thể chất khi chào đời
Mức độ hoàn thiện thể chất của đứa trẻ cũng rất quan trọng cho quá trình phát triển hệ sinh vật đường ruột. Những đứa trẻ sinh ra trước 37 tuần tuổi được xếp vào nhóm sinh non. Có một nghiên cứu trước đây cho thấy sự thay đổi thành phần hệ vi sinh ở người mẹ cũng có thể là một nguyên nhân dẫn đến nguy cơ sinh non [9]. Thuốc kháng sinh, thiết bị cung cấp thức ăn và hô hấp nhân tạo, thời gian theo dõi trong bệnh viện sau đó lại góp phần làm ảnh hưởng sự phát triển hệ vi sinh ở đứa trẻ. Ở nhóm trẻ này, những lợi khuẩn kị khí như Bifidobacterium hoặc Bacteroides cho thấy tham gia chậm hơn bình thường trong khi các loài vi khuẩn cơ hội gây bệnh như Enterobacteriaceae, Enterococcus, hay một số loài cơ hội gây bệnh khác nhanh chóng xâm lấn vào đường ruột [10-15]. Trong đó, vi khuẩn gram dương (Staphylococcus, Enterococcus hay clostridia) xuất hiện nhiều hơn còn nhóm khuẩn gram âm (Enterobacteriaceae and Veillonella) thì tùy trường hợp [16].
Ngoài thành phần thì chức năng hệ vi sinh cũng bị thay đổi. Thông thường, hệ vi sinh đường ruột trẻ từ 3 tuổi trở đi sẽ dần ổn định và tương tự như người lớn. Tuy nhiên, quá trình này trên nhóm trẻ sinh non hơi chậm, khiến chúng nhạy cảm hơn với các bệnh viêm, nhiễm [17-19]. Các acid béo chuỗi ngắn cần thiết cho đường ruột sản sinh ít hơn, biểu hiện gene liên quan chuyển hóa năng lượng, phản ứng sinh hóa tổng hợp và vitamin cũng ít hơn, nhiều dẫn xuất acid dịch mật hơn [13, 20]. Mặc dù nhìn chung hệ vi sinh đường ruột ở nhóm trẻ này thường nhạy cảm và dễ tổn thương hơn nhưng không có nghĩa là mọi trường hợp đều giống nhau bởi còn nhiều yếu tố khác phối hợp tác động.
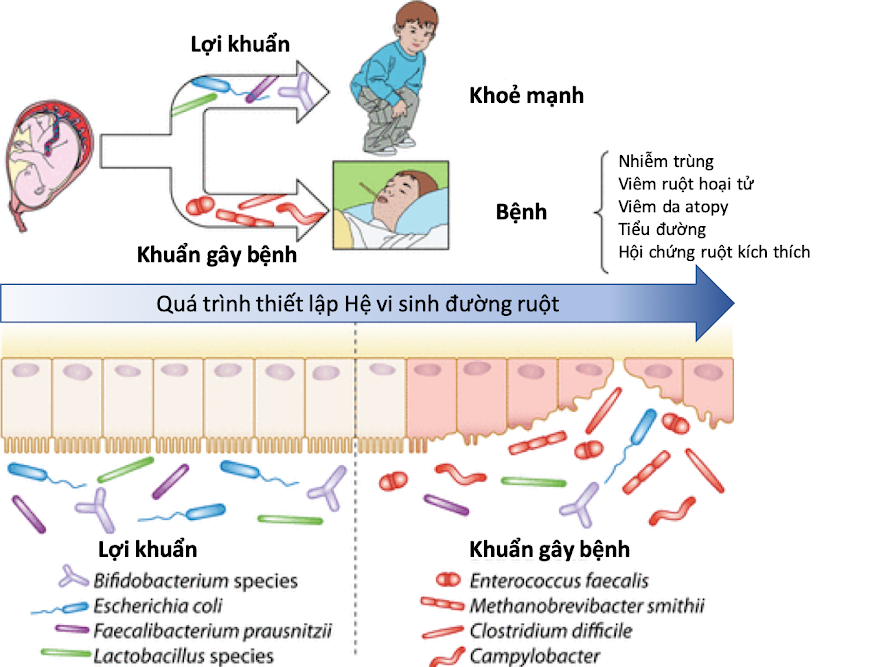
Hình 2. Các lợi khuẩn và vi khuẩn gây bệnh phổ biến có mặt trong hệ vi sinh đường ruột của trẻ (Milani et al., 2017) IBD/IBS là gì?
2.2. Cách thức người mẹ sinh
Cách thức người mẹ sinh ảnh hưởng đến quá trình thiết lập và phát triển hệ vi sinh vật đường ruột của đứa trẻ, thậm chí đây là một yếu tố cực kì quan trọng [1]. Các nhà nghiên cứu ở Wellcome Sanger Institute, UCL, Đại học Birmingham đã thu thập 1679 mẫu cho nghiên cứu về hệ vi sinh vật đường ruột ở 600 trẻ sơ sinh và 175 người mẹ. Bằng phương pháp giải trình tự DNA và phân tích gene, các nhà nghiên cứu đã phát hiện một kết quả bất ngờ giữa hai cách sinh: Nhóm trẻ sinh ra theo cách thông thường, không cần can thiệp thuốc hay phẫu thuật (nhóm trẻ sinh thường) cho thấy được thụ hưởng nhiều lợi khuẩn từ người mẹ hơn nhóm trẻ được sinh bằng phẫu thuật bắt trẻ (nhóm trẻ sinh mổ). Ngoài lợi khuẩn, một số khuẩn ở khu vực âm đạo cũng sẽ đi vào theo đứa trẻ (thông thường là Lactobacillus và Prevotella) [21, 22]. Tuy nhiên, nghiên cứu này đã chỉ ra rằng số vi khuẩn ở âm đạo người mẹ không đáng kể và không tồn tại nhiều trong đứa trẻ như chúng ta đã nghĩ.
Ngược lại, nhóm trẻ sinh mổ lại đối mặt một tình huống khác hoàn toàn. Hầu hết vi khuẩn ở hệ vi sinh của nhóm trẻ sinh mổ lại có nguồn gốc từ bệnh viện nơi các bé sinh hơn là sở hữu các lợi khuẩn đường ruột thông thường từ mẹ (thông thường là Bifidobacterium và Bacteroides) [1, 22]. Hàm lượng các cytokine (các chất dẫn truyền thông tin cho tế bào miễn dịch hoạt động) cũng cho thấy giảm rõ rệt [23]. Trong nghiên cứu này ở Anh Quốc , các nhà khoa học đã phát hiện hơn 800 loài vi khuẩn gây bệnh là từ bệnh viện các bé được sinh. Mặc dù các vi khuẩn đó có khả năng gây bệnh rất thấp nhưng với nguồn gốc vi khuẩn như vậy thì nhóm trẻ này cũng có nguy cơ kháng thuốc hơn so với nhóm sinh thường [1]. Ở các nước tiên tiến, có một phương pháp thứ cấp dành cho nhóm trẻ sinh mổ là “phết dịch âm đạo” nhằm củng cố hệ vi sinh bị thiếu cho trẻ sơ sinh. Tuy nhiên như đã nói là có rất ít vi khuẩn ở âm đạo người mẹ ở trong đứa trẻ, nghiên cứu này đã không ủng hộ phương pháp đó vì nó thậm chí có thể chuyển các vi khuẩn gây bệnh qua đứa trẻ thay vì các lợi khuẩn ở đường ruột [1]. Bên cạnh đó, tất cả các ca sinh mổ đều được đề nghị sử dụng thuốc kháng sinh trước khi sinh để giúp phòng ngừa việc nhiễm trùng hậu phẫu nhưng điều này cũng có nghĩa là một phần thuốc kháng sinh sẽ thấm qua nhau thai đến trẻ nhỏ, dẫn đến sự khác biệt ở tổ chức hệ vi sinh đường ruột. Nhìn chung, các chuyên gia của Đại học Hoàng gia chuyên về sản và phụ khoa Anh Quốc (Royal College of Obstetricians and Gynaecologists) cho rằng dù nhóm trẻ sinh thường có vẻ thụ hưởng được nhiều lợi ích hơn so với nhóm còn lại nhưng chúng ta không nên cực đoan vào kết quả này và khiến phụ nữ tránh việc sinh mổ vì việc lựa chọn phương pháp sinh thế nào vẫn còn phụ thuộc vào nhiều yếu tố. Tác động do phương pháp sinh lên hệ vi sinh đường ruột sẽ giảm dần sau một năm đầu đời nhưng nó vẫn tiếp tục để lại tác động đến sức khỏe nói chung cho đến giai đoạn trưởng thành. Và đây cũng chính là lí do vì sao hệ vi sinh đường ruột phần nào đã báo hiệu từ sớm khả năng hoàn thiện hệ thống miễn dịch chúng ta.
(Còn tiếp)
Tài liệu tham khảo
- ScienceDaily. (2019). Babies' gut bacteria affected by delivery method: Vaginal delivery promotes mother's gut bacteria in babies' gut.
- Milani, C., Duranti, S., Bottacini, F., Casey, E., Turroni, F., Mahony, J., Belzer, C., Delgado Palacio, S., Arboleya Montes, S., Mancabelli, L., Andrea Lugli, G., Miguel Rodriguez, J., Bode, L., de Vois, W., Gueimonde, M., Margolles, A., van Sinderen, D. and Ventura, M. (2019). The First Microbial Colonizers of the Human Gut: Composition, Activities, and Health Implications of the Infant Gut Microbiota. [online] Available at: https://mmbr.asm.org/content/81/4/e00036-17#ref-79 [Accessed 5 Oct. 2019].
- Jiménez, E., Fernández, L., Marín, M., Martín, R., Odriozola, J., Nueno-Palop, C., Narbad, A., Olivares, M., Xaus, J. and Rodríguez, J. (2005). Isolation of Commensal Bacteria from Umbilical Cord Blood of Healthy Neonates Born by Cesarean Section. Current Microbiology, 51(4), pp.270-274.
- DiGiulio, D., Romero, R., Amogan, H., Kusanovic, J., Bik, E., Gotsch, F., Kim, C., Erez, O., Edwin, S. and Relman, D. (2008). Microbial Prevalence, Diversity and Abundance in Amniotic Fluid During Preterm Labor: A Molecular and Culture-Based Investigation. PLoS ONE, 3(8), p.e3056.
- Aagaard, K., Ma, J., Antony, K., Ganu, R., Petrosino, J. and Versalovic, J. (2014). The Placenta Harbors a Unique Microbiome. Science Translational Medicine, 6(237), pp.237ra65-237ra65.
- Lauder, A., Roche, A., Sherrill-Mix, S., Bailey, A., Laughlin, A., Bittinger, K., Leite, R., Elovitz, M., Parry, S. and Bushman, F. (2016). Comparison of placenta samples with contamination controls does not provide evidence for a distinct placenta microbiota. Microbiome, 4(1).
- Salter, S., Cox, M., Turek, E., Calus, S., Cookson, W., Moffatt, M., Turner, P., Parkhill, J., Loman, N. and Walker, A. (2014). Reagent and laboratory contamination can critically impact sequence-based microbiome analyses. BMC Biology, 12(1).
- Perez-Muñoz, M., Arrieta, M., Ramer-Tait, A. and Walter, J. (2017). A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome, 5(1).
- Prince, A., Ma, J., Kannan, P., Alvarez, M., Gisslen, T., Harris, R., Sweeney, E., Knox, C., Lambers, D., Jobe, A., Chougnet, C., Kallapur, S. and Aagaard, K. (2016). The placental membrane microbiome is altered among subjects with spontaneous preterm birth with and without chorioamnionitis. American Journal of Obstetrics and Gynecology, 214(5), pp.627.e1-627.e16.
- Hill, C., Lynch, D., Murphy, K., Ulaszewska, M., Jeffery, I., O’Shea, C., Watkins, C., Dempsey, E., Mattivi, F., Tuohy, K., Ross, R., Ryan, C., O’Toole, P. and Stanton, C. (2017). Erratum to: Evolution of gut microbiota composition from birth to 24 weeks in the INFANTMET Cohort. Microbiome, 5(1).
- Rougé, C., Goldenberg, O., Ferraris, L., Berger, B., Rochat, F., Legrand, A., Göbel, U., Vodovar, M., Voyer, M., Rozé, J., Darmaun, D., Piloquet, H., Butel, M. and de La Cochetière, M. (2010). Investigation of the intestinal microbiota in preterm infants using different methods. Anaerobe, 16(4), pp.362-370.
- Neu, J. (2011). Dynamics and Clinical Evolution of Bacterial Gut Microflora in Extremely Premature Patients. Yearbook of Neonatal and Perinatal Medicine, 2011, pp.109-112.
- Arboleya, S., Binetti, A., Salazar, N., Fernández, N., Solís, G., Hernández-Barranco, A., Margolles, A., los Reyes-Gavilán, C. and Gueimonde, M. (2011). Establishment and development of intestinal microbiota in preterm neonates. FEMS Microbiology Ecology, 79(3), pp.763-772.
- Arboleya, S., Sánchez, B., Milani, C., Duranti, S., Solís, G., Fernández, N., de los Reyes-Gavilán, C., Ventura, M., Margolles, A. and Gueimonde, M. (2015). Intestinal Microbiota Development in Preterm Neonates and Effect of Perinatal Antibiotics. The Journal of Pediatrics, 166(3), pp.538-544.
- Cong, X., Xu, W., Janton, S., Henderson, W., Matson, A., McGrath, J., Maas, K. and Graf, J. (2016). Gut Microbiome Developmental Patterns in Early Life of Preterm Infants: Impacts of Feeding and Gender. PLOS ONE, 11(4), p.e0152751.
- Aujoulat, F., Roudière, L., Picaud, J., Jacquot, A., Filleron, A., Neveu, D., Baum, T., Marchandin, H. and Jumas-Bilak, E. (2014). Temporal dynamics of the very premature infant gut dominant microbiota. BMC Microbiology, 14(1).
- Collado, M., Cernada, M., Neu, J., Pérez-Martínez, G., Gormaz, M. and Vento, M. (2015). Factors influencing gastrointestinal tract and microbiota immune interaction in preterm infants. Pediatric Research, 77(6), pp.726-731.
- Madan, J., Salari, R., Saxena, D., Davidson, L., O'Toole, G., Moore, J., Sogin, M., Foster, J., Edwards, W., Palumbo, P. and Hibberd, P. (2012). Gut microbial colonisation in premature neonates predicts neonatal sepsis. Archives of Disease in Childhood - Fetal and Neonatal Edition, 97(6), pp.F456-F462.
- Mai, V., Torrazza, R., Ukhanova, M., Wang, X., Sun, Y., Li, N., Shuster, J., Sharma, R., Hudak, M. and Neu, J. (2013). Distortions in Development of Intestinal Microbiota Associated with Late Onset Sepsis in Preterm Infants. PLoS ONE, 8(1), p.e52876.
- Arboleya, S., Sánchez, B., Solís, G., Fernández, N., Suárez, M., Hernández-Barranco, A., Milani, C., Margolles, A., de los Reyes-Gavilán, C., Ventura, M. and Gueimonde, M. (2016). Impact of Prematurity and Perinatal Antibiotics on the Developing Intestinal Microbiota: A Functional Inference Study. International Journal of Molecular Sciences, 17(5), p.649.
- Seri, I. (2011). Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Yearbook of Neonatal and Perinatal Medicine, 2011, pp.15-16.
- Biasucci, G., Rubini, M., Riboni, S., Morelli, L., Bessi, E. and Retetangos, C. (2010). Mode of delivery affects the bacterial community in the newborn gut. Early Human Development, 86(1), pp.13-15.
- Jakobsson, H., Abrahamsson, T., Jenmalm, M., Harris, K., Quince, C., Jernberg, C., Björkstén, B., Engstrand, L. and Andersson, A. (2013). Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by Caesarean section. Gut, 63(4), pp.559-566.
- Malamitsi-Puchner, A., Protonotariou, E., Boutsikou, T., Makrakis, E., Sarandakou, A. and Creatsas, G. (2005). The influence of the mode of delivery on circulating cytokine concentrations in the perinatal period. Early Human Development, 81(4), pp.387-392.
Thanh Võ
Miễn trừ trách nhiệm:
Bài viết là nội dung tổng hợp từ các nghiên cứu khoa học và nền tảng cho các nghiên cứu khoa học sau này, được dịch lại bởi tác giả nhằm cung cấp thông tin cho đọc giả. Bài viết không phải là tài liệu tiên quyết để áp dụng chế độ dinh dưỡng, sức khỏe cho cá nhân hay tổ chức.
Miễn trừ trách nhiệm cho các cách thức trị bệnh, lựa chọn y tế,… dựa trên tài liệu này mà không có tham vấn của bác sĩ hoặc chuyên viên trong lĩnh vực y tế.


