Ánh sáng kì diệu
Trần Thanh Long
Phòng Thí nghiệm Công nghệ Sinh học Phân tử, khoa Sinh học-Công nghệ Sinh học, Đại học Khoa học Tự nhiên Tp.HCM
Kỳ 3: Câu chuyện của những Prometheus
Thắp sáng sự sống
Theo như nhận định của nhà khoa học thứ hai cùng chia sẻ giải Nobel hóa học 2008, Martin Chalfie, các khám phá khoa học bắt đầu tự sự quan sát. Càng thấy nhiều, các nhà khoa học càng hiểu biết nhiều hơn. Từ giải Nobel vật lí đầu tiên được trao vào năm 1901 cho Wilhelm Röntgen vì công trình khám phá tia X và ứng dụng đáng kinh ngạc trong việc quan sát bộ xương người mà không cần mổ xẻ. Những năm sau đó, nhiều công trình được trao giải Nobel y sinh, vật lí lẫn hóa học đều là những cống hiến giúp các nhà nghiên cứu có thể quan sát tốt hơn thế giới tự nhiên: giải Nobel y sinh 1906 cho Camillo Golgi, người phát triển kĩ thuật nhuộm bạc nitrate để quan sát neuron và Santiago Ramón y Cajal đã cải thiện và ứng dụng kĩ thuật trên để nghiên cứu hệ thần kinh, từ đó đặt nền móng cho sinh học thần kinh hiện đại; William và Lawrence Bragg đạt giải Nobel vật lí 1915 cho công trình về nghiên cứu tinh thể học bằng tia X; kính siêu hiển vi (Richard Zsigmondy, Nobel hóa học 1925), kính hiển vi đối pha (Frits Zernike, Nobel vật lí 1953) và kính hiển vi điện tử (Ernst Ruska, Nobel vật lí 1986) đã trở thành những công cụ không thể thiếu trong nghiên cứu sinh học; Nobel vật lí 1952 trao cho Felix Bloch và E. M. Purcell về nghiên cứu cộng hưởng từ hạt nhân… [1]
Công trình Nobel hóa học năm 2008 tiếp nối chuỗi thành tựu trên khi tiếp tục cung cấp cho các nhà nghiên cứu một công cụ mới để quan sát thế giới tự nhiên. Martin Chalfie chính là người chứng minh cho giới khoa học thấy được tiềm năng ứng dụng to lớn của GFP. Tuy nhiên, ngay từ khi còn rất trẻ, Chalfie không nghĩ rằng mình sẽ theo đuổi con đường nghiên cứu đến suốt đời như ngày nay. Từ nhỏ, ông đã có niềm hứng thú với khoa học, tuy nhiên, sau một một đợt trải nghiệm ở phòng thí nghiệm vào mùa hè, khi mà tất cả các thí nghiệm ông thực hiện đều thất bại, Chalfie chán nản và quyết định sẽ tránh xa con đường nghiên cứu. Chalfie trải qua nhiều công việc khác nhau bao gồm cả giáo viên trung học. Tuy nhiên, vào một kì nghỉ hè, ông quyết định cho mình thêm một cơ hội nữa khi đến làm việc với giáo sư José Zadunaisky ở trường y khoa Yale. Những thí nghiệm thành công mùa hè đó cùng với sự hỗ trợ từ giáo sư hướng dẫn đánh thức lại niềm đam mê khoa học trong Chalfie, ông có thêm tự tin để đăng kí vào khoa sinh lý học ở đại học Harvard vào năm 1972 và sau đó tiếp tục nghiên cứu sau tiến sĩ tại phòng thí nghiệm sinh học phân tử MRC (Medical Research Council). Tại đây, ông bắt đầu làm việc với niềm đam mê suốt đời của mình: nghiên cứu về hệ thần kinh của loài giun tròn Caenorhabditis elegans. Trước đó, vào năm 2002, các đồng nghiệp của ông đã giành được giải Nobel y sinh cho những khám phá về quá trình điều hòa di truyền trong quá trình phát triển cơ quan và sự chết tế bào theo chương trình. Đối tượng nghiên cứu chính của các nhà khoa học này là loài Caenorhabditis elegans. Chủ nhân của giải Nobel y sinh năm 2002 không những là đồng nghiệp mà còn là những người giúp đỡ, đưa ra những lời khuyên và cả truyền cảm hứng cho Chalfie theo đuổi việc nghiên cứu trên loài giun trong suốt trên. Trước khi biết đến GFP, Chalfie tập trung tìm hiểu về sự biểu hiện gene trong hệ thần kinh của Caenorhabditis elegans. Sở dĩ loài động vật này được chọn là mô hình nghiên cứu do cơ thể trong suốt của chúng tạo thuận lợi cho việc quan sát trực tiếp các protein mục tiêu được đánh dấu. [1]
Vào lúc ấy, có ba phương pháp thường được sử dụng để kiểm tra sự biểu hiện gene và sinh tổng hợp protein:
- Đầu tiên là phương pháp sử dụng những kháng thể chuyên biệt với protein mục tiêu. Những kháng thể này được đánh dấu bằng các phương pháp vật lí hoặc hóa học (gắn với chất phóng xạ hoặc các hóa chất có khả năng phát quang) và sau đó đưa các kháng thể này vào cơ thể giun đã được xử lý để kháng thể gắn đặc hiệu với protein mục tiêu.
- Phương pháp thứ hai là dung hợp gene mục tiêu với gene mã hóa enzyme β-galactosidase của vi khuẩn E. coli. Đây là một enzyme thủy phân β-galactoside thành đường đơn. Sau khi dung hợp gene của protein mục tiêu cần nghiên cứu biểu hiện với gene β-galactosidase, gene dung hợp được đưa trở lại vào hợp tử giun Caenorhabditis elegans. Hợp tử sau đó phát triển thành giun trưởng thành và gene dung hợp sẽ được biểu hiện ở một số tế bào chuyên biệt để tạo thành một protein dung hợp gồm protein mục tiêu kết nối với enzyme β-galactosidase. Cơ thể giun sau đó được xử lí với X-gal, một chất tương đồng với β-galactoside, enzyme β-galactosidase sẽ hủy phân X-gal tạo thành sản phẩm có màu xanh. Vì vậy, có thể dễ dàng nhận biết những mô hoặc tế bào mà protein mục tiêu biểu hiện mạnh.
- Phương pháp cuối cùng là lai tại chỗ với mẫu dò oligonucleotide. Mẫu mô từ được cho là sẽ có sự biểu hiện mạnh của gene mục tiêu được phân lập từ cơ thể giun, sau đó được xử lí bằng hóa chất và mẫu dò đã đánh dầu được đưa vào mô. Mẫu dò này có bản chất là một đoạn oligonucleotide mạch đơn có trình tự bổ xung với mRNA của gene mục tiêu. Nếu gene mục tiêu được biểu hiện mạnh, mRNA của gene sẽ tồn tại với số lượng lớn trong mẫu mô và các mRNA này sẽ bắt cặp bổ xung với các mẫu dò. Các đoạn mẫu dò cũng được đánh dấu bằng chất phang quang, chất phóng xạ hoặc như các kháng thể ở phương pháp thứ nhất. Từ đó, sự biểu hiện mạnh hay yếu của gene sẽ được phát hiện dựa trên cường độ tín hiệu từ các mẫu dò được đánh dấu. Vào thời điểm trước khi biết đến GFP, Chalfie sử dụng cả ba phương pháp trên để nghiên cứu biểu hiện gene ở hệ thần kinh giun Caenorhabditis elegan. [1] [2]
Hình 7: A: vị trí của 6 tế bào thần kinh thụ thể tiếp xúc trên cơ thể Caenorhabditis elegan, những tế bào mà Chalfie muốn theo dõi. B: Kết quả nhuộm miễn dịch với kháng thể đặc hiệu cho một protein của hệ thần kinh là MEC-7 β-tubulin. C: Hoạt tính của β-galactosidase được biểu hiện khi dung hợp protein này với protein mec-9 của tế bào thần kinh thụ thể tiếp xúc. D: Lai tại chỗ với mẫu dò chuyên biệt cho mec-7 mRNA. [1]
Cả ba phương pháp này đều có nhược điểm. Cá thể giun đều phải chết, được cố định và đưa kháng thể, X-gal hoặc mẫu dò vào mô. Vì vậy, các nhà khoa học chỉ có thể quan sát được các mô hoặc cơ thể chết, một bức tranh tĩnh vật đúng nghĩa. Nếu muốn nghiên cứu sự thay đổi trong suốt quá trình phát triển, nhà nghiên cứu phải so sánh kết quả từ nhiều cá thể khác nhau trong nhiều giai đoạn khác nhau, việc chuẩn bị mẫu sẽ rất mất thời gian và công sức, đó là chưa kể đến các điều kiện sinh lí, sinh hóa khác nhau ở từng cá thể có thể là những biến số ảnh hưởng đến kết quả cuối cùng.
Nếu không làm việc với loài sinh vật trong suốt như Caenorhabditis elegan, Chalfie chắc chắn sẽ phớt lờ khi lần đầu tiên nghe về GFP. Đó là vào một buổi chiều thứ ba, 25 tháng 4, 1989. Cơ quan nơi ông làm việc có một buổi seminar cho các nhà khoa học quan tâm đến sinh học thần kinh. Người thuyết trình hôm đó giới thiệu về các chất phát quang ở sứa và các loài động vật khác. Đầu tiên là về aequorin, một protein mà Chalfie đã biết trước đó như là một chất chỉ thị ion calcium. Nhưng sau đó, khi diễn giả bắt đầu nói về GFP, Chalfie lập tức bị cuốn hút. Toàn bộ kiến thức và kinh nghiệm suốt những năm làm việc với loài giun trong suốt kết nối với những thông tin mới vừa được giới thiệu, một ý tưởng lóe lên trong đầu Chalfie về việc sử dụng GFP làm chất chỉ thị sinh học. Toàn bộ phần còn lại của buổi seminar trôi tuột khỏi tai Chalfie, ông quá phấn khích về những gì mình đang nghĩ tới. [1]
Sau đó, Chalfie lập tức tìm hiểu và biết được Douglas Prasher, một nhà khoa học đang cố gắng dòng hóa cDNA (đoạn DNA phiên mã ngược từ mRNA của một gene) của GFP. Sau khi liên hệ và có một cuộc trò chuyện thành công, hai nhà khoa học quyết định hợp tác, Prasher sẽ gửi cDNA của GFP cho Chalfie khi ông dòng hóa thành công. Sau một số trục trặc, cuối cùng Chalfie cũng nhận được đoạn cDNA đã được dòng hóa thành công vào virus lambda. Đoạn cDNA của GFP được chèn thêm một trình tự đặc biệt vào đầu 5’ và 3’ để giúp cho đoạn cDNA này có thể được nối vào bộ gene của virus lambda. Theo ý tưởng của mình, đầu tiên, Chalfie muốn cắt đoạn cDNA này khỏi bộ gene của virus lambda và chuyển vào vi khuẩn E. coli để kiểm tra khả năng biểu hiện của GFP ở một loài sinh vật khác. Để cắt đoạn cDNA khỏi bộ gene virus, Chalfie phải sử dụng enzyme cắt giới hạn (những enzyme phân cắt DNA tại các vùng trình tự xác định chuyên biệt), tuy nhiên nếu làm vậy, đoạn cDNA của GFP sẽ có thêm hai vùng trình tự DNA thừa ở đầu 5’ và 3’. Đoạn thừa này nều cùng được phiên mã và dịch mã với cDNA của GFP có thể tạo thêm các amino acid mới ảnh hưởng đến cấu trúc bậc ba của GFP. Vì vậy, Chalfie quyết định sử dụng một phương pháp mạo hiểm vào thời điểm đó là PCR. PCR là một phương pháp sao chép nhân tạo một trình tự DNA bất kì nằm trong một chuỗi DNA ban đầu. Nhà nghiên cứu chỉ cần tổng hợp nhân tạo cặp DNA mồi có khả năng bắt cặp bổ sung với 2 đoạn DNA chắn ở hai đầu 5’ và 3’ của trình tự mục tiêu. Sau đó sử dụng enzyme DNA polymerase đặc biệt để sao chép toàn bộ trình tự DNA mục tiêu. Cuối cùng, sẽ thu được một số lượng lớn bản sao của đoạn DNA mục tiêu được sao chép từ khuôn ban đầu. Vào thời điểm đó, PCR là một phương pháp mới mẻ và cần được cải tiến do enzyme DNA polymerase được sử dụng có xu hướng gắn nhầm một số nucleotide trong quá trình tổng hợp đoạn DNA mới. Bất chấp rủi ro trên, Chalfie đã thiết kế một cặp mồi chuyên biệt chỉ khuyếch đại đúng trình tự của cDNA GFP từ bộ gene virus lambda mà không kèm theo đoạn trình tự thừa ở hai đầu. Sau đó, đoạn cDNA này được một cộng sự của Chalfie chuyển vào E. coli và đã biểu hiện thành công protein GFP có hoạt tính khi các vi khuẩn chuyển gene phát ánh sáng xanh lục dưới kính hiển vi huỳnh quang. Kết quả này đã chứng minh tiềm năng to lớn của GFP cũng như phá bỏ niềm tin rằng GFP chỉ có thể hình thành chromophore nhờ các enzyme đặc biệt trong sứa Aequorea aequorea. [1]
Hình 8: Sơ đồ quá trình PCR khuyếch đại gene mục tiêu từ một khuôn mẫu ban đầu. [3]
Hình 9: Ý tưởng ứng dụng GFP bằng cách dung hợp gene GFP với gene của protein mục tiêu.
Trên hình là thí nghiệm của Douglas Prasher:
A: gene mã hóa hemoglobin và protein hemoglobin tự nhiên;
B: dung hợp gene hemoglobin với gene GFP để tạo nên protein dung hợp, từ đó theo dõi
được hemoglobin. [4]
Hình 10: Đường ria bên trái: E. coli thường. Đường ria bên phải: E. coli biểu hiện GFP. [1]
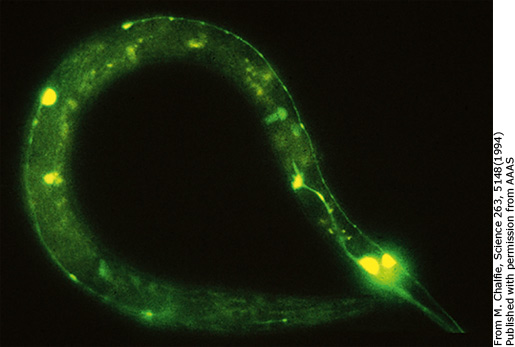
Sau này, Chalfie phát hiện ra rằng cũng có một số nhà khoa học có ý định chuyển gene GFP vào các loài sinh vật khác bằng cách sử dụng enzyme cắt giới hạn như trên. Tất cả đều thất bại và các nhà khoa học càng tin vào giả thuyết enzyme hỗ trợ, từ đó, không ai nghĩ đến việc ứng dụng GFP vào các nghiên cứu khác. Quyết định mạo hiểm sử dụng một phương pháp mới mẻ như PCR lại giúp cho Chalfie mang về một giải Nobel có thể khiến nhiều nhà nghiên cứu can đảm hơn khi sử dụng những phương pháp, kĩ thuật mới (nhà khoa học sáng tạo nên kĩ thuật PCR cũng được trao giải Nobel hóa học năm 1998!). Thành công bước đầu với E. coli càng thôi thúc ông mang thứ ánh sáng kì diệu này về với tình yêu của đời mình. Một lần nữa, thí nghiệm lại thành công khi GFP phát sáng ở những tế bào thần kinh thụ thể tiếp xúc (touch receptor neuron). Các kết quả càng được đảm bảo khi các protein phát huỳnh quang xanh ở E. coli có phổ hấp thụ và phát xạ giống hệt như của GFP tự nhiên. Thành công trên của Chalfie và nhóm nghiên cứu đã tạo nên một cú hích cho nhu cầu sử dụng cDNA của GFP. Hàng loạt các nhà khoa học trên thế giới lao vào đặt hàng gene GFP và háo hức tìm cách ứng dụng vào công trình của mình. Đối với Chalfie, ông chỉ xem thành công trên như một công cụ hữu ích để tiếp tục nghiên cứu, quan sát loài giun bé nhỏ trong suốt, chỉ khác là lần này, không cá thể nào phải chết. [1]
Hình 11: A: Vị trí của các tế bào thần kinh thụ thể tiếp xúc. B: Các tế bào thần kinh phát sáng khi GFP dung hợp với một protein của tế bào thần kinh là MEC-17. [5]
Còn tiếp...
Tài liệu tham khảo:
|
[1] |
M. Chalfie, "GFP, lighting up life," in The Nobel prize in chemistry 2008, Stockholm, 2008. |
|
[2] |
"In situ hybridization," Wikipedia, [Online]. Available: https://en.wikipedia.org/wiki/In_situ_hybridization. |
|
[3] |
B. Victor, "Technique of polymerase chain reaction (pcr) experimental biotechnology," [Online]. Available: https://www.slideshare.net/biotechvictor1950/technique-of-polymerase-chain-reaction-pcr-experimental-biotechnology. |
|
[4] |
M. Zimmer, "History of GFP - Douglas Prasher," Connecticut college, [Online]. Available: https://www.conncoll.edu/ccacad/zimmer/GFP-ww/prasher.html#DNA. |


