
Duc-Hiep Bach
Department of Gynecologic Oncology and Reproductive Medicine, The University of Texas MD Anderson Cancer Center, Houston, TX 77030, USA
Corresponding author: Duc-Hiep Bach. Email: bdhiep90@gmail.com
Tổng quan:
Nhiễm sắc thể (NST) là vật thể di truyền tồn tại trong nhân tế bào, có khả năng nhuộm màu đặc trưng bằng thuốc nhuộm kiềm tính, do các phân tử DNA được cuộn lại dưới dạng cấu trúc nhỏ như sợi chỉ (1). Hầu hết các khối u ác tính đều cho thấy sự bất thường trong việc chia tách nhiễm sắc thể ở giai đoạn phân chia của tế bào. Những hiện tượng bất thường này chiếm một vai trò quan trọng trong sự phát triển của khối u bởi việc tăng tỷ lệ đột biến NST, bao gồm việc khóa hay khuếch đại những gen quan trọng liên quan tới sự tồn tại và phát triển của tế bào. Vì vậy, sự thay đổi NST là nguyên nhân chủ yếu dẫn tới tính không đồng nhất của hệ gen ở các khối u. Những nghiên cứu in vitro (nghiên cứu trong ống nghiệm) đã cho thấy rằng sự bất ổn của quá trình phân bào được cho là cơ chế chính trong việc gây ra hiện tượng kháng thuốc. Sự bất ổn định của NST không chỉ có vai trò trong ứng dụng chẩn đoán và tiên lượng ung thư mà còn có vai trò đặc biệt trong các đáp ứng điều trị. Trong bài viết này, chúng tôi sẽ sơ lược những nguyên nhân và hệ quả chính của sự bất ổn NST trong ung thư và cũng tập trung vào các đáp ứng điều trị với mục tiêu NST.
Sự bất ổn nhiễm sắc thể và ung thư
Sự bất ổn NST thường liên quan tới việc mất hay sự sắp xếp lại của các NST trong suốt quá trình tế bào phân chia (2). Sự bất ổn NST là hiện tượng phổ biến hay xuất hiện ở các khối u ác tính và được chia ra như đột biến về cấu trúc NST hay đột biến số lượng NST (3). Trong đó, đột biến số lượng NST được xác định bởi việc tăng thêm hay mất đi của tổng số NST (aneuploidy – tính lệch bội không hoàn chỉnh, thường được gọi là hiện tượng lệch bội lẻ trong y học) và sự bất ổn về số lượng có thể do việc mất NST ở kỳ giữa/kỳ sau hoặc do sự phân chia đa cực liên quan tới cấu trúc hay số lượng bất thường của trung thể trong khi đột biến cấu trúc NST thường được xác định là liên quan tới việc tăng lên hay mất đi các đoạn của NST (3) (Hình 1).
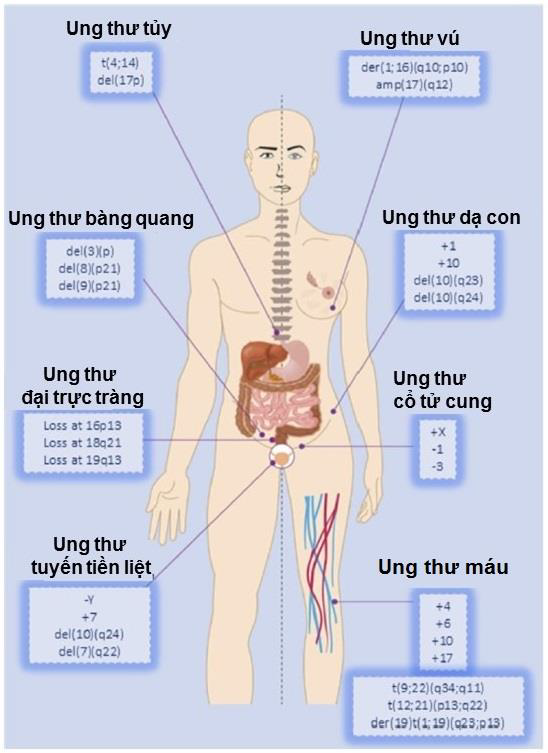
Hình 1: Đột biến nhiễm sắc thể xuất hiện ở nhiều khối u trong cơ thể. Đột biến NST liên quan tới việc tăng lên hay mất đi các đoạn NST và điều này có thể xảy ra ở nhiều khối u trong cơ thể như là ung thư tuyến tiền liệt; ung thư đại tràng; ung thư bang quang… như trong hình. (Amp: sự khuếch đại; loss: sự mất; del: sự xóa đi.)
Những cơ chế giải thích dẫn tới sự bất ổn của NST cho tới bây giờ vẫn còn có những giới hạn nhất định và chủ yếu nêu ra sự rối loạn chức năng sao chép của NST hay sự rối loạn chức năng chia tách trong quá trình phân bào. Những cơ chế dẫn tới sự bất ổn định NST thường là: lỗi kết dính tâm động và vi cấu trúc; dính bất thường nhiễm sắc thể chị em hay sao chép trung thể bất thường…(4).
Vai trò của sự bất ổn NST trong sự phát triển của ung thư là một đề tài tranh cãi lớn. Một số nhà nghiên cứu đã chỉ ra rằng sự bất ổn NST xảy ra ở giai đoạn sớm trong chất sinh ung thư dẫn tới việc mất hay bất hoạt các gen ức chế khối u (5, 6) trong khi một số khác lại cho rằng sự bất ổn NST tác động lên sự phát triển của khối u, đặc biệt là trong suốt quá trình tế bào ung thư mất hay tăng thêm số NST (7). Thêm vào đó, sự bất ổn NST cũng được cho là liên quan tới việc kháng thuốc trong quá trình phát triển của ung thư (8) (Hình 2) (1).
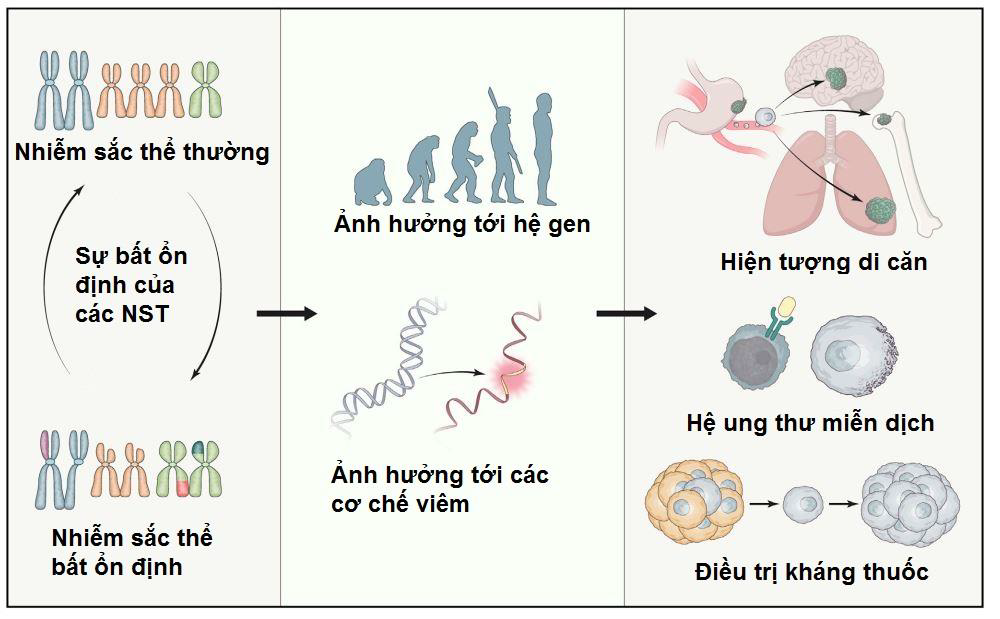
Hình 2: Sự bất ổn nhiễm sắc sẽ ảnh hưởng tới hệ gen cũng như các cơ chế viêm, từ đó gây ảnh hưởng tới hiện tượng di căn, khả năng đáp ứng của hệ miễn dịch và khả năng điều trị với thuốc.
Thông thường, sự bất ổn NST cũng được xem là những chỉ thị sinh học trong tiên lượng ung thư máu hay các khối u khác, đó cũng chính là lý do tại sao những giá trị lâm sàng của sự bất ổn NST trong ung thư người được nêu ra gần đây (9-11). Thêm nữa, có những báo cáo chỉ ra rằng sự bất ổn NST là cao nhất trong các loại ung thư di căn (12).
Vai trò của sự bất ổn NST trong đáp ứng điều trị ung thư
Tầm quan trọng của sự bất ổn NST trong đáp ứng điều trị xuất phát từ giá trị thực tế rằng sự thay đổi NST chính là nguyên nhân thay đổi hệ tương tác gen và rất nhiều nồng độ protein khác, cả 2 hướng này đều ảnh hưởng đến đáp ứng của tế bào tới điều trị (13). Hơn nữa, sự bất ổn cao NST cũng liên quan tới sự sống của bệnh nhân ung thư và hiện tượng kháng thuốc trong điều trị (14). Những điều này cho thấy rằng, mục tiêu nghiên cứu sự bất ổn NST cho điều trị ung thư có thể là tăng sự thay đổi hệ gen, và sự thay đổi hệ gen cũng có thể ảnh hưởng ngược lại tới sự tăng bất ổn định của NST.
Phương pháp xác định sự bất ổn NST
Phương pháp FISH (Fluorescence in situ hybridization) thường được sử dụng phổ biến nhất để đánh giá sự bất ổn NST trong các mẫu bệnh phẩm bệnh nhân ung thư (14-17), và những nghiên cứu đã chỉ ra rằng kỹ thuật này có thể dùng kết hợp với các phương pháp như CGH (comparative genomic hybridization) hay SNP (single-nucleotide polymorphism), qua đó cải thiện hiệu quả trong việc đánh giá sự bất NST, và vì vậy có thể đưa ra các bằng chứng chính xác hơn về việc tăng sự bất ổn NST có thể liên quan chặt chẽ tới đáp ứng điều trị hay không (18, 19). Tuy nhiên, trước khi xem xét sự bất ổn NST như là liệu pháp điều trị thì sự bất ổn NST cần phải được đánh giá và kiểm soát một cách chắn chắn trước khi chính thức được sử dụng trong lâm sàng như những công cụ trong dự đoán các loại ung thư, điều này sẽ ảnh hưởng đặc biệt tới phương thức điều trị của cá nhân mỗi người (20, 21).
Bất ổn NST giúp tiên lượng hiệu quả điều trị
Nhiều nghiên cứu đã chỉ ra rằng, sự bất ổn NST ảnh hưởng trực tiếp tới sự phát triển của khối u và sự gia tăng các bệnh liên quan khác ở nhiều loại ung thư. Hơn nữa, sự bất ổn NST ở trong các khối u ác tính thường liên quan nhiều tới di căn (14, 22, 23). Vì vậy, trong những trường hợp mà tăng sự bất ổn NST chi phối tới sự phát triển của khối u, việc kết hợp các phương pháp phân tích như thử nghiệm lâm sàng, phân tích single-cell, sử dụng tin y sinh hay phân tích các mẫu lâm sàng sẽ cải thiện đáng kể sự hiểu biết về cơ chế và vai trò của sự bất ổn NST trong sự phát triển của khối u. Qua đó, mục tiêu điều trị sự bất ổn NST sẽ không chỉ là dấu ấn trong sinh học mà còn là phương thức nhằm cải thiện hệ miễn dịch hay các hiện tượng di căn trong cơ thể (Hình 3) (1).
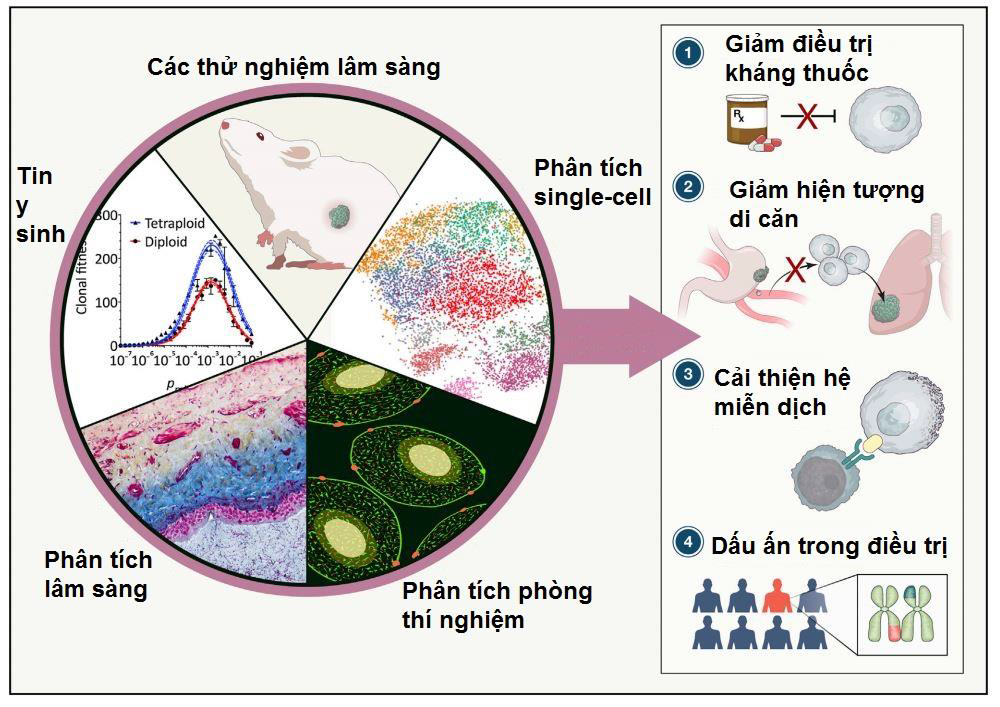
Hình 3: Hướng ứng dụng của sự bất ổn NST sẽ giúp cải thiện tình trạng kháng thuốc, di căn, miễn dịch và cả tiên lượng trong điều trị.
Kết luận: Như vậy, hướng ứng dụng của sự bất ổn NST sẽ giúp điều hòa và cả thiện hệ miễn dịch, đồng thời còn làm dấu ấn trong điều trị ung thư. Nghiên cứu gần đây còn chỉ ra rằng, mục tiêu điều trị sự bất ổn NST còn cải thiện đáng kể hiện tượng di căn, qua đó cải thiện hiện tượng kháng thuốc trong điều trị (1). Tuy nhiên, đây vẫn là hướng đi mới và vẫn đang trong quá trình thu thập các thử nghiệm lâm sàng, vì vậy, việc nghiên cứu hơn nữa để hiểu thêm về cơ chế và tầm soát hoạt động của sự bất ổn NST sẽ được coi là hướng đi triển vọng trong tương lai gần.
Tài liệu tham khảo:
1. Bakhoum SF & Cantley LC (2018) The Multifaceted Role of Chromosomal Instability in Cancer and Its Microenvironment. Cell 174(6):1347-1360.
2. McClelland SE (2017) Role of chromosomal instability in cancer progression. Endocr Relat Cancer 24(9):T23-t31.
3. Tanaka K & Hirota T (2016) Chromosomal instability: A common feature and a therapeutic target of cancer. Biochim Biophys Acta 1866(1):64-75.
4. Thompson SL, Bakhoum SF, & Compton DA (2010) Mechanisms of chromosomal instability. Curr Biol 20(6):R285-295.
5. Hanahan D & Weinberg RA (2011) Hallmarks of cancer: the next generation. Cell 144(5):646-674.
6. Michor F, Iwasa Y, Vogelstein B, Lengauer C, & Nowak MA (2005) Can chromosomal instability initiate tumorigenesis? Semin Cancer Biol 15(1):43-49.
7. Kops GJ, Weaver BA, & Cleveland DW (2005) On the road to cancer: aneuploidy and the mitotic checkpoint. Nat Rev Cancer 5(10):773-785.
8. Giam M & Rancati G (2015) Aneuploidy and chromosomal instability in cancer: a jackpot to chaos. Cell Div 10:3.
9. Diaz LA, Jr. (2005) The current clinical value of genomic instability. Semin Cancer Biol 15(1):67-71.
10. Florl AR & Schulz WA (2008) Chromosomal instability in bladder cancer. Arch Toxicol 82(3):173-182.
11. Walther A, Houlston R, & Tomlinson I (2008) Association between chromosomal instability and prognosis in colorectal cancer: a meta-analysis. Gut 57(7):941-950.
12. Orsetti B, et al. (2014) Impact of chromosomal instability on colorectal cancer progression and outcome. BMC Cancer 14:121.
13. Dayal J, Albergante L, J Newman T, & South A (2015) Quantitation of multiclonality in control and drug-treated tumour populations using high-throughput analysis of karyotypic heterogeneity. Convergent Science Phys Oncol. p 025001.
14. McGranahan N, Burrell RA, Endesfelder D, Novelli MR, & Swanton C (2012) Cancer chromosomal instability: therapeutic and diagnostic challenges. EMBO Rep 13(6):528-538.
15. Cyll K, et al. (2017) Tumour heterogeneity poses a significant challenge to cancer biomarker research. Br J Cancer 117(3):367-375.
16. Xu Y, et al. (2017) Detection of Circulating Tumor Cells Using Negative Enrichment Immunofluorescence and an In Situ Hybridization System in Pancreatic Cancer. Int J Mol Sci 18(4).
17. Stomornjak-Vukadin M, Kurtovic-Basic I, Mehinovic L, & Konjhodzic R (2015) Combined use of cytogenetic and molecular methods in prenatal diagnostics of chromosomal abnormalities. Acta Infor Medica 23(2):68-72.
18. Roylance R, et al. (2011) Relationship of extreme chromosomal instability with long-term survival in a retrospective analysis of primary breast cancer. Cancer Epidemiology, Biomarkers & Prevention 20(10):2183-2194.
19. Birkbak NJ, et al. (2011) Paradoxical relationship between chromosomal instability and survival outcome in cancer. Cancer Res 71(10):3447-3452.
20. Potapova TA, Zhu J, & Li R (2013) Aneuploidy and chromosomal instability: a vicious cycle driving cellular evolution and cancer genome chaos. Cancer Metastasis Rev 32(3-4):377-389.
21. Penner-Goeke S, et al. (2017) The temporal dynamics of chromosome instability in ovarian cancer cell lines and primary patient samples. PLoS Genet 13(4):e1006707.
22. Swanton C, et al. (2009) Chromosomal instability determines taxane response. Proc Natl Acad Sci U S A 106(21):8671-8676.
23. Jamal-Hanjani M, et al. (2017) Tracking the Evolution of Non-Small-Cell Lung Cancer. New Engl J Med 376(22):2109-2121.


