Tác giả: Dương Thị Nhung
Trường Đại học Nghiên cứu Quốc gia về Hạt nhân “MEPhI” (Liên bang Nga)
Email: duongthinhung_t57@hus.edu.vn
Xạ trị bằng proton là một phương pháp hiệu quả để điều trị một số loại ung thư. Sự vượt trội của phương pháp này dựa trên cơ sở vật lý, sinh học và đã được chứng minh trên lâm sàng. Tuy nhiên, số lượng bệnh nhân được điều trị bằng phương pháp này vẫn còn khiêm tốn do đòi hỏi kỹ thuật và giá thành cao.
1. Cơ sở vật lý và sinh học của xạ trị proton
Hạt proton ký hiệu 1P1, là hạt nhân tích điện dương với q= +1.6 x 10-19 C, khối lượng m = 1.6 x 10-17kg (gấp 1840 lần khối lượng của electron). Khi hạt proton đi qua môi trường, chúng sẽ tương tác với electron nguyên tử và hạt nhân thông qua lực tương tác Coulomb. Một số va chạm của proton với hạt nhân nguyên tử có thể gây ra phản ứng hạt nhân nhưng trường hợp đó rất hiếm.
Sự tương tác thông qua lực Coulomb có thể là lực tương tác đàn hồi hoặc không đàn hồi. Khi tương tác đàn hồi, năng lượng của proton được bảo toàn. Còn khi tương tác không đàn hồi, động năng của proton sẽ bị mất dưới dạng ion hóa hoặc gây kích thích nguyên tử môi trường.
Do proton có khối lượng lớn hơn electron rất nhiều lần, nên góc tán xạ gây nên do proton nhỏ hơn so với electron. Như vậy, chùm proton có phân bố “sắc nét” hơn so với chùm electron. Điều này rất quan trọng khi xem xét tới độ chính xác của phương pháp đem lại (2).
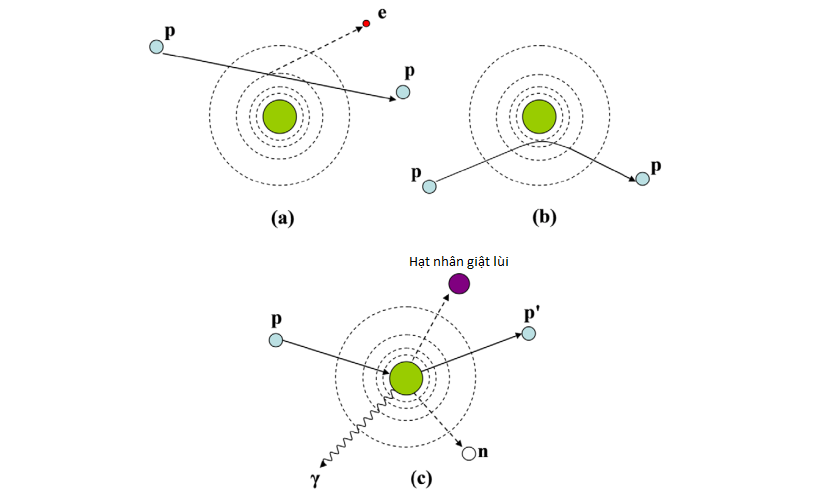
Hình 1: Cơ chế tương tác của proton với nguyên tử môi trường thông qua tương tác với electron (a), tán xạ Coulomb với hạt nhân nguyên tử (b) và phản ứng hạt nhân (c) (3)
Tất cả các quá trình tương tác của proton với vật chất, được mô tả bởi đỉnh Bragg hay Bragg-peak.
Vậy Bragg-peak là gì, và có ý nghĩa như thế nào trong việc điều trị?
LET (Linear energy transfer) là hệ số truyền năng lượng tuyến tính thường được dùng để xác định tốc độ mất mát năng lượng của hạt tích điện khi di chuyển trong nước và thường được biểu diễn bằng đơn vị keV/µm. Đây là một trong những thông số cơ bản có liên quan đến sự tích lũy năng lượng trong môi trường mà hạt truyền qua và hiệu ứng sinh học của bức xạ.
Tốc độ mất mát năng lượng do ion hóa và kích thích nguyên tử môi trường tỉ lệ với bình phương độ lớn điện tích và tỉ lệ nghịch với tốc độ của hạt. Tốc độ mất mát này tuân theo công thức Bethe-Block. Như vậy, sự mất mát năng lượng của hạt sẽ nhỏ hơn khi vận tốc lớn và sẽ đạt cực đại khi tốc độ của hạt tiến về không.
Sự phân bố liều sâu tỷ lệ với tốc độ mất mát năng lượng trong môi trường. Đối với chùm proton đơn năng, tốc độ mất mát ở độ sâu ban đầu tăng chậm và sau đó tăng đột ngột ở điểm gần cuối quãng chạy. Sự tăng đột ngột đó hay điểm tích lũy liều gần cuối quãng chạy của hạt được gọi là Bragg-peak. Tuy nhiên, Bragg-peak với chùm proton đơn năng quá mảnh để điều trị toàn bộ thể tích bia. Do vậy để cung cấp dải chiều sâu rộng hơn, Bragg-peak có thể được trải ra bằng việc tổng hợp một số chùm tia với năng lượng khác nhau, được gọi là đỉnh Bragg trải rộng (Spread-out Bragg Peak - SOBP).
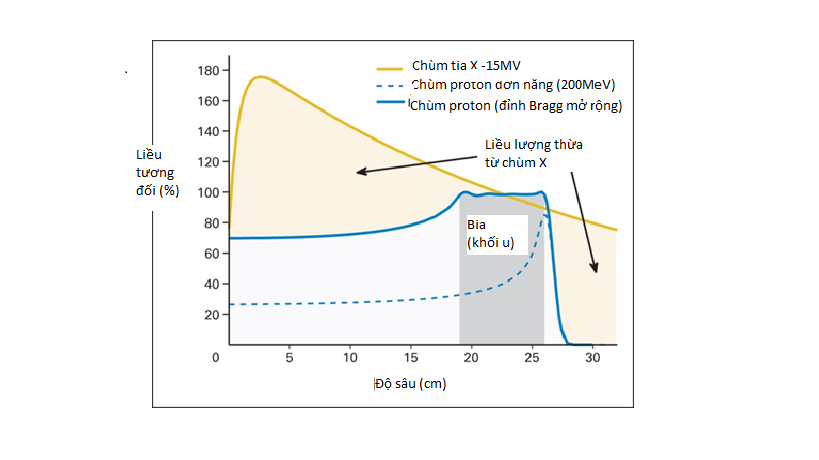
Hình 2: So sánh sự phân bố liều theo độ sâu của chùm proton với chùm photon 15MV (1)
Như vậy, khối u sẽ nhận liều tối đa ở tại SOBP và giảm nhanh về không ở vùng sau khối u. Điều này giúp tránh được các tổn thương tới các mô lành nằm ở phía sau khối u. Ngoài ra, liều tích lũy trước Bragg-peak chỉ bằng 30% so với liều tại đỉnh. Trong khi đó, liều tương đối của chùm photon đạt cực đại ở gần lối vào và sau đó giảm khi đi qua khối u.
Ngoài ra, để đánh giá mức độ hiệu quả mà một chùm bức xạ đem lại, dựa vào hiệu suất sinh học tương đối (Relative biologic effectiveness - RBE). Đó là tỷ số liều của chùm tia X 250 kVp và chùm bức xạ gây lên cùng một hiệu ứng sinh học được quy định. Hiệu ứng sinh học được quy định bao gồm sự giết chết tế bào, tổn thương mô, đột biến hay bất kỳ điểm cuối sinh học (biologic endpoint)* khác. Mặc dù RBE phụ thuộc vào loại và phẩm chất chùm tia, phân đoạn liều và biologic endpoint, nhưng yếu tố quyết định RBE là LET. Khi LET càng lớn thì RBE càng lớn. Do với đối với các hạt tích điện thì thường có RBE lớn hơn 1.0.
*Ghi chú: Thuật ngữ biologic endpoint dùng để chỉ các tác động tiêu cực tới tế bào khối u. Dạng biologic endpoint mà nhà trị liệu quan tâm nhất là gây chết tế bào, nhưng biologic endpoint cũng có thể là các tổn thương ở mức độ thấp hơn).
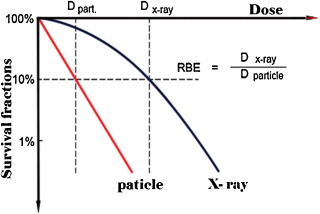
Hình 3: So sánh các đường cong sinh tồn của chùm hạt tích điện với LET cao và X rays
Từ hình 3 cho thấy độ dốc của đường cong sinh tồn lớn hơn với chùm bức xạ có LET cao. Do vậy hiệu quả sinh học của chùm hạt tích điện nặng nói chung và proton nói riêng cao hơn.
2. Ưu điểm và một số kết quả ứng dụng lâm sàng
2.1. Ưu điểm
Bragg-peak là một trong những ưu thế vượt trội của chùm proton. Điều này giúp làm giảm liều độc hại tới các mô lành xung quanh, đặc biệt những cơ quan trọng yếu của cơ thể nằm sau khối u. Chùm proton có hiệu suất sinh học cao (RBE cao) liên quan đến LET cao nên khả năng tiêu diệt khối u lớn hơn trong thời gian ngắn. Ưu điểm vượt trội với một số loại khối u nhất định và ung thư ở trẻ em.
2.2. Một số kết quả của việc ứng dụng lâm sàng
Ung thư vùng đầu cổ: Có nhiều phương pháp để điều trị khối u vùng khoang mũi và các xoang cánh mũi bằng cách kết hợp giữa phẫu thuật và xạ trị bằng photon. Tuy nhiên kết quả đạt được vẫn chưa thỏa đáng. Tỉ lệ sống sót không mắc bệnh trở lại (relapse-free survival), ở các giai đoạn T1-T3 không quá 82%, còn ở giai đoạn T4 là 50%. Trong thời gian điều trị, tần suất và mức độ nghiêm trọng của biến chứng do điều trị dẫn đến việc giảm liều và gián đoạn kế hoạch điều trị. Việc điều trị cho các khối u nằm trong vùng hộp sọ rất khó, trong một số trường hợp không thể điều trị do vị trí khối u gần thân não. Việc ứng dụng phương pháp 3D-CRT (kỹ thuật xạ trị 3 chiều theo hình dạng khối u) cho các khối u xoang cánh mũi dẫn đến mù lòa do bệnh võng mạc hay bệnh thần kinh thị giác trong gần một nửa số bệnh nhân (24-40%). Trong khi đó việc điều trị bằng proton cho các khối u khoang mũi và xoang cánh mũi cho thấy những lợi thế nhất định. Nghiên cứu của Okano và các đồng tác giả trên 13 bệnh nhân ung thư biểu bì xoang hàm giai đoạn T4b trải qua hóa trị và xạ trị bằng proton, nhận thấy 85% bệnh nhân hồi quy hoàn toàn (loại bỏ khối u 100%) và không có bệnh nhân nào bị mất thị lực và hoại tử não.
Một nghiên cứu khác đánh giá việc kết hợp giữa điều trị bằng proton với phẫu thuật và thuốc đối với bệnh nhân có khối u vùng xương bướm. Chỉ số kiểm soát cục bộ trong 2 năm với liều 76 Gy là 86%, tỉ lệ sống sót không mắc bệnh trở lại là 31%, khả năng sống sót tổng thể là 53%.
Trong việc điều trị các khối u mũi họng và hầu họng, các nhà lâm sàng thường ưu tiên sử dụng phương pháp hóa trị kết hợp xạ trị. Kỹ thuật xạ trị đối với chùm photon là IMRT cho thấy giảm tỷ lệ biến chứng như khô miệng và khó nuốt. Tuy nhiên, các nghiên cứu cho thấy sự phân bố liều của chùm proton mang lại nhiều lợi thế hơn bao gồm có việc bao phủ bia tốt hơn và giảm liều có hại tới các mô lành.
Xạ trị bằng proton không chỉ áp dụng cho các khối u nguyên phát mũi họng và hầu họng, mà còn đối với những bệnh nhân bị tái phát sau xạ trị. Kết quả nghiên cứu của Lin và các đồng tác giả đã tiến hành việc nghiên cứu trên 16 bệnh nhân bị tái phát khối u vùng khoang mũi sau một đợt xạ trị bằng photon. Điều trị bằng chùm proton với liều lượng 60-70 Gy cho tỷ lệ kiểm soát cục bộ và tỷ lệ sống sót không tái phát là 50%. Một số tác dụng phụ nghiêm trọng được ghi nhận bao gồm loét niêm mạc họng (1 bệnh nhân) và hoại tử xương (1 bệnh nhân). Không có biến chứng nào liên quan đến các cơ quan hệ thần kinh trung ương (4).
Ung thư ở trẻ nhỏ: Những lợi thế chủ yếu của việc điều trị bằng proton là rủi ro phát triển khối u sau chiếu xạ (bảng 1) và chỉ số nhiễm xạ (bảng 2) thấp.
Bảng 1: Xác suất phát triển khối u bị nhiễm xạ sau chiếu xạ vùng sọ - đốt sống với u nguyên bào tủy (4)
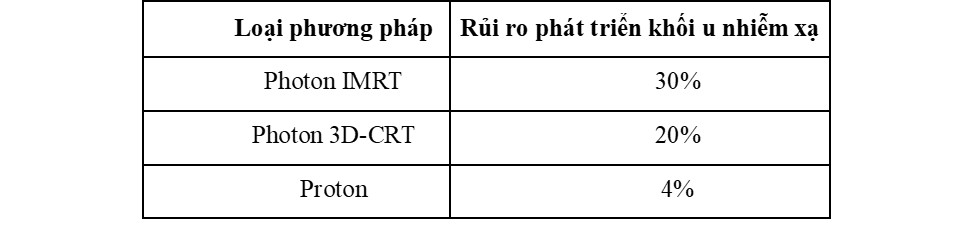
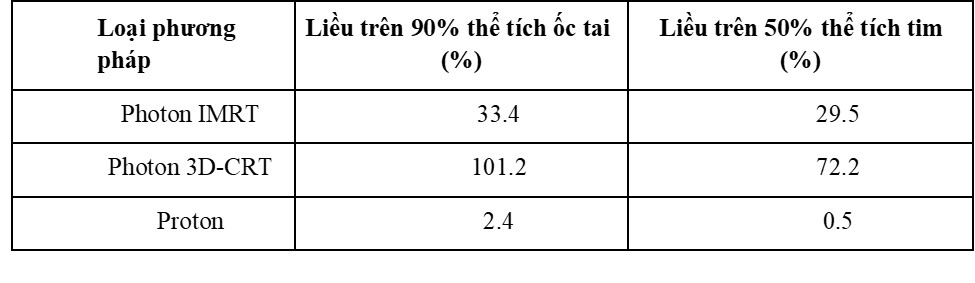
Bảng 2: Các chỉ số nhiễm xạ trên ốc tai và tim khi tiến hành chiếu xạ vùng sọ-cột sống với u nguyên bào tủy của các phương pháp khác nhau (4)
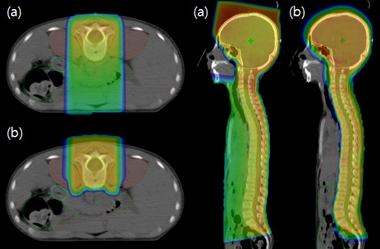
Hình 4: Lợi thế trong việc giảm liều có hại tới các tổ chức nguy cấp bằng proton (b) so với việc điều trị bằng photon (a) (4)
Ngoài ra, điều trị bằng proton đặc biệt thích hợp cho các khối u nơi photon điều trị khó khăn hoặc không thể điều trị do các tác dụng phụ như:
- Các khối u hệ thần kinh trung ương
- U nguyên sống và u mô liên kết sụn
- Ung thư phổi
- Ung thư tuyến tiền liệt
- Các khối u ở mắt
Nhược điểm của xạ trị proton
Bên cạnh những ưu điểm của việc xạ trị bằng proton, tỷ lệ bệnh nhân được chữa trị bằng phương pháp này vẫn còn ít so với các bức xạ thông thường vì một số lý do sau (5):
- Chỉ hiệu quả đối với một số loại ung thư. Các bệnh ung thư ảnh hưởng tới toàn bộ cơ thể như bạch cầu, bệnh lymphoma ác tính, ung thư dạ dày không thể điều trị bằng liệu pháp proton.
- Chi phí điều trị hiện nay cho một ca còn khá cao.
- Do kỹ thuật phức tạp nên chỉ có một vài trung tâm điều trị trên thế giới có khả năng tiến hành.
- Chi phí xây dựng trung tâm xạ trị proton còn rất cao (khoảng trên 3000 tỷ VNĐ), bao gồm các khoản đầu tư: xây dựng, vận hành, nhân sự, dụng cụ trong chiếu xạ… Trong đó chi phí cho máy gia tốc là tốn kém nhất.
- Khu vực điều trị proton phải đủ lớn để có thể đặt máy gia tốc và các đường truyền dẫn chùm tia.
Tài liệu tham khảo:
1. Efstathiou, J. A., Gray, P. J., & Zietman, A. L. (2013) Proton beam therapy and localised prostate cancer: current status and controversies. British journal of cancer, 108(6), 1225.
2. Faiz M. Khan (2014) The Physics of Radiation Therapy (LIPPINCOTT WILLIAMS & WILKINS, Philadelphia, PA 19103 USA), pp 524–527. 5th Ed.
3. Newhauser, W. D., & Zhang, R. (2015) The physics of proton therapy. Physics in Medicine & Biology, 60(8), R155.
5. Phạm Khắc Tuyên (2017) Xạ trị Proton. Tạp chí Khoa học và Công nghệ hạt nhân (51): 20-26.


