Tổng hợp và biên dịch: Huỳnh Thị Diễm Phúc
Phần 2: Các hoạt động ảnh hưởng trực tiếp đến chương trình ngoại kiểm
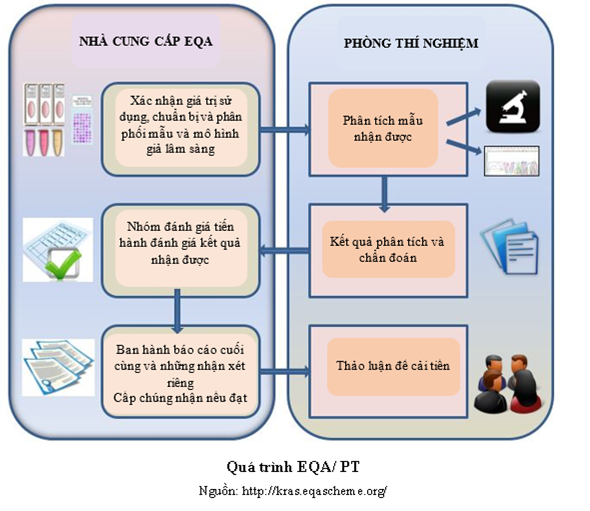
Các yếu tố chính trong thiết kế một chương trình ngoại kiểm
Có nhiều yếu tố cần cân nhắc trong việc lựa chọn một chương trình EQA/ PT, yếu tố đầu tiên và quan trọng nhất là các mẫu hoạt động giống như mẫu bệnh phẩm. Thuộc tính này thường được gọi là “có khả năng hoán đổi” (commutability). Một mẫu “có khả năng hoán đổi” là mẫu tương đương về mặt toán học đối với các mẫu lâm sàng, giữa tất cả các quy trình đo lường khác nhau được trình bày trong khảo sát (9). Khả năng hoán đổi và ảnh hưởng đối với EQA/ PT và các mẫu chuẩn khác đã được mô tả trong một số đánh giá (10, 11). Nhiều nghiên cứu cho thấy các mẫu bệnh phẩm thay thế thường từ vật liệu EQA/ PT không có khả năng thay thế các mẫu lâm sàng tự nhiên do thao tác và thay đổi chất nền mẫu trong quá trình chuẩn bị vật liệu EQA/ PT (12, 13). Do các giới hạn không thể thay thế, kết quả EQA/ PT từ các vật liệu này phải được so sánh với giá trị trung bình của kết quả từ những người tham gia sử dụng quy trình đo lường và hệ thống chẩn đoán có độ chệch ma trận giống nhau hoặc gần giống nhau. Việc phân loại thành “nhóm đồng đẳng” (sử dụng các điều kiện đo giống hoặc gần giống cả về thiết bị và phương pháp) cung cấp thông tin hữu ích cho một đơn vị tham gia nhưng không chấp nhận cải tiến hài hòa và kết quả đồng thuận giữa các phòng thí nghiệm liên phòng. Hơn nữa, tính có thể thay thế của các vật liệu ảnh hưởng mạnh mẽ đến các giá trị tham chiếu chuẩn và mức độ mà các mẫu EQA/ PT có giá trị tham chiếu chuẩn bị ảnh hưởng. Do đó, sử dụng quy trình đo lường tham chiếu trên mẫu EQA/ PT để ấn định các giá trị mục tiêu từ đó xác định vật liệu có thể thay thế các mẫu lâm sàng gốc hay không. Ngược lại, khi không có mẫu EQA/ PT có tính thay thế, phương án phổ biến nhất vẫn được áp dụng là phân loại các phương pháp tham gia thành các nhóm đồng đẳng đại diện cho các kỹ thuật tương tự. Số lượng phòng thí nghiệm tham gia phải đảm bảo để đạt độ tin cậy khi so sánh kết quả “nhóm đồng đẳng”. Tuy nhiên, ngày nay các trở ngại lớn này đã không còn. Đã có nhiều công bố về các chương trình EQA/ PT sử dụng các mẫu có thể thay thế (14, 15).
Một vấn đề cơ bản khác của chương trình EQA/ PT là việc áp dụng các quy trình thống kê thích hợp và các mục tiêu dựa trên bằng chứng để đánh giá độ tin cậy của kết quả phòng thí nghiệm. Đặc biệt, điều kiện tiên quyết để đảm bảo năng lực và hiệu quả của các chương trình EQA/ PT là việc thiết kế chương trình này dựa trên các đặc điểm chất lượng có giá trị (16). Hệ thống phân cấp các mô hình được xác định trong Hội nghị Stockholm 1999 đại diện cho một quan điểm có giá trị trong thiết lập thông số kỹ thuật chất lượng (17).
Quy trình xử lý mẫu tại phòng thí nghiệm tham gia EQA/PT
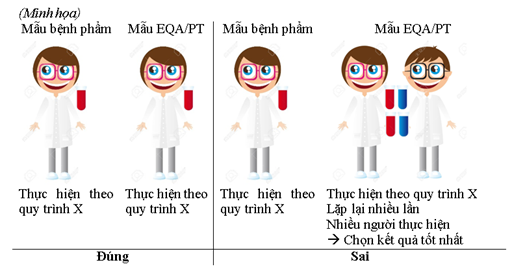
Các mẫu EQA/ PT cần được thực hiện tương tự như đối với mẫu bệnh phẩm đến mức có thể. Trên thực tế, những mẫu này thường đòi hỏi một số thao tác chuẩn bị, nhưng những thao tác này có thể nhận diện mẫu EQA/ PT với các mẫu lâm sàng thông thường. Một số chương trình cung cấp các mẫu giống với các mẫu lâm sàng, do đó tránh một số bước chuẩn bị này. Cung cấp các vật liệu có thể thay thế sẽ tạo ra lợi thế cạnh tranh cho các phòng thí nghiệm tham gia. Trong trường hợp cần có các quy trình chuẩn bị và xử lý đặc biệt, cần tiến hành theo hướng dẫn cụ thể của nhà cung cấp EQA/ PT. Điểm lưu ý quan trọng nhất trong thực hiện mẫu là tuyệt đối không được quá ưu tiên thực hiện lặp đi lặp lại nhiều lần mẫu EQA/ PT trong khi mẫu bệnh nhân chỉ thực hiện một lần. Hoặc tất cả kỹ thuật viên tiến hành thực hiện mẫu EQA/ PT, sau đó chọn ra kết quả tốt nhất. Vì như vậy không phản ánh đúng bản chất thực sự của EQA/ PT trong cải tiến chất lượng phòng thí nghiệm (3).
Nhập dữ liệu và xem xét trên trình duyệt web
Trong những năm gần đây, sử dụng web hỗ trợ nhiều cho các chương trình EQA/ PT. Nhiều chương trình có thể nhập dữ liệu và đánh giá kết quả thông qua internet (18). Điều này làm giảm thời gian gửi và nhận báo cáo EQA/ PT, đồng thời giảm nguy cơ sao chép dữ liệu và kết quả. Tuy nhiên, một số chương trình yêu cầu gửi kết quả EQA/ PT ít nhất một lần/năm với cùng định dạng của báo cáo của các mẫu lâm sàng và bệnh nhân (19). Từ đó hỗ trợ xác minh, đánh giá các đơn vị đo lường hiệu quả và các giá trị tham chiếu, do đó cho phép một số cân nhắc sau phân tích. Một số chương trình đặc biệt được phát triển để đánh giá chất lượng của các nhận xét khuyến nghị (được biết đến như công cụ giúp cải tiến chất lượng phòng thí nghiệm) (20).
Phần 3: Lợi ích của việc thực hiện EQA/PT
Giám sát chất lượng
Một số nghiên cứu cho thấy EQA/ PT như là một phần của phương pháp tiếp cận tích cực, chủ động để quản lý chất lượng phòng thí nghiệm. Các phòng thí nghiệm phải chủ động trong:
a) Thu hẹp phạm vi kiểm soát chất lượng nội bộ;
b) Tăng tần suất hiệu chuẩn;
c) Kiểm định thiết bị;
d) Kiểm tra chặt chẽ xu hướng và độ chệch kết quả EQA/ PT, ngay cả khi được xem là chấp nhận được.
Tuy nhiên, cũng như các hệ thống quản lý khác, chương trình EQA/ PT không thể tự cải tiến chất lượng phân tích, chỉ có thể cho thấy đang có điểm nào đó không ổn. Do đó, chỉ khi thay đổi quá trình và quy trình tại phòng thí nghiệm mới có thể cải thiện chất lượng dịch vụ phòng thí nghiệm. Để đánh giá một kết quả EQA/PT đạt hay không, cần kết hợp theo dõi các kết quả trong thời gian dài. Việc theo dõi liên tục EQA/ PT giúp các phòng thí nghiệm lâm sàng có bức tranh hoàn chỉnh và đáng tin cậy về chất lượng hàng ngày của họ. Hơn nữa, việc này giúp đưa ra các hành động khắc phục, hành động phòng ngừa một cách hiệu quả (3).
Thành tựu hiện tại và triển vọng tương lai
Belk và Sunderman (1947) đã phát triển hiệu quả đánh giá chất lượng phòng thí nghiệm (21). Những kinh nghiệm tiên phong trong lĩnh vực hóa học lâm sàng đã dần chuyển sang hầu như tất cả các lĩnh vực phòng xét nghiệm, góp phần cải tiến chất lượng phân tích. Ngày nay, các chương trình EQA/ PT cải tiến chất lượng phòng thí nghiệm ở phương diện giáo dục, khuyến nghị và tiêu chuẩn hóa, dự kiến hướng đến yêu cầu nghiêm ngặt hơn thay vì giới hạn trong đánh giá cuối cùng. Nhiều chương trình EQA/ PT bao gồm các nhận xét đánh giá khả năng của các phòng thí nghiệm để xác nhận tính phù hợp về mặt y học. Tiêu chuẩn quốc tế công nhận các phòng xét nghiệm khuyến khích sử dụng các chương trình EQA/ PT xem xét nguồn gốc lỗi trước và sau phân tích. Do đó, các chương trình EQA/ PT truyền thống là công cụ hữu ích để đánh giá và cải thiện chất lượng phân tích, các chương trình đặc trưng sẽ đánh giá các quá trình trước và sau của 1 quy trình phân tích. Nếu mục tiêu bao quát và cuối cùng của EQA/ PT là nâng cao chất lượng chăm sóc và an toàn cho bệnh nhân thông qua cải tiến chất lượng dịch vụ phòng thí nghiệm, thì các lợi ích khác phải được nhấn mạnh (nêu trong Bảng bên dưới)
Lợi ích của các chương trình EQA (22)

Gần đây, dữ liệu về chất lượng EQA/ PT dùng để đánh giá hiệu quả đào tạo, kinh nghiệm và tay nghề của kỹ thuật viên xét nghiệm. Một nghiên cứu hồi cứu tìm mối tương quan giữa kết quả EQA/ PT với tay nghề của kỹ thuật viên xét nghiệm. Kết quả nghiên cứu cho thấy những người tham gia không có chuyên ngành khoa học lâm sàng và chỉ có từ 2 năm kinh nghiệm trở xuống có tỷ lệ gây lỗi gần gấp đôi (23).
Tóm lại, vai trò của EQA/ PT là cung cấp thông tin đáng tin cậy để các phòng thí nghiệm đánh giá và giám sát tình trạng chất lượng các quá trình và quy trình nội bộ. Đồng thời đánh giá tính phù hợp của hệ thống chẩn đoán, trách nhiệm và năng lực của nhân viên. Hơn nữa, nó có vai trò quan trọng trong xác định độ không đảm bảo đo của kết quả phòng thí nghiệm (24).
Các nghiên cứu khác nhau đã chứng minh rằng: chỉ có sử dụng thông tin được cung cấp từ EQA/ PT mới có thể cải tiến chất lượng phòng thí nghiệm (23). Thông tin EQA/ PT phải nêu bật được:
- Khuyết điểm của hệ thống phòng thí nghiệm,
- Nhân viên phòng thí nghiệm phải chịu trách nhiệm thực hiện mẫu EQA/ PT tương tự như đối với mẫu bệnh phẩm (trong phạm vi có thể),
- Phân tích thông tin nhận được cẩn thận, phát hiện xu hướng hoặc độ chệch có thể không rõ ràng trong các kết quả đơn lẻ,
- Điều tra nguyên nhân gốc rễ dẫn đến giảm chất lượng,
- Giám sát và ứng dụng các cơ hội nhằm loại bỏ nguyên nhân của sự cố, xác minh hiệu quả thực hiện. Trên hết, xác định xem sự cố có gây ảnh hưởng đến chăm sóc bệnh nhân hay không.
Tóm tắt
Ngoại kiểm tra chất lượng (gọi tắt là ngoại kiểm - External Quality Assessment - EQA) và thử nghiệm thành thạo (Proficiency Testing - PT) là những công cụ hữu ích trong quá trình cải tiến chất lượng. Các công cụ này cung cấp bằng chứng khách quan về năng lực của phòng thí nghiệm cho các cá nhân, tổ chức quan tâm (như khách hàng của phòng thí nghiệm, cơ quan kiểm định và các cơ quan quản lý). Các chương trình EQA/ PT truyền thống có xu hướng chỉ nhắm đến quá trình trong xét nghiệm, một số chương trình cải tiến gần đây đánh giá cả hoạt động trước và sau phân tích của phòng xét nghiệm. Những yếu tố quan trọng nhất trong lựa chọn chương trình EQA/ PT gồm: (i) mẫu mang tính chất có thể thay thế (tức là chúng hoạt động giống như mẫu bệnh phẩm), (ii) giá trị tham chiếu có thể truy nguyên được, (iii) có thể so sánh phương pháp với các nhóm đồng đẳng, (iv) quy mô của nhóm đồng đẳng phù hợp về mặt thống kê, (v) tính kịp thời và hữu ích của bản báo cáo. Đánh giá 1 kết quả EQA/ PT kết hợp theo dõi tất cả các kết quả theo thời gian và giám sát chất lượng là một vấn đề khó khăn đối với các phòng xét nghiệm. Quan trọng là mọi chương trình EQA/ PT đều có một số hạn chế nhất định, nên không thể chỉ dùng EQA/ PT để đánh giá chất lượng phòng thí nghiệm. Do đó, để theo dõi và cải tiến chất lượng chẩn đoán của phòng thí nghiệm phải sử dụng kết hợp nội kiểm tra chất lượng (gọi tắt là nội kiểm -internal quality control - IQC), EQA/ PT và các công cụ khác.
Tài liệu tham khảo:
1. Westgard JO. (2010). Managing quality vs. measuring uncertainty in the medical laboratory. Clin Chem Lab Med, 48, 3-40.
2. Westagard JO. (2003). Internal quality control: planning and implementation strategies. Ann Clin Biochem, 40, 593-611.
3. Clinical and Laboratory Standards Institute (CLSI) (2007). Using Proficiency Testing to improve the clinical laboratory; Approved Guideline-Second Edition. CLSI document GP27-A2. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA.
4. ISO/IEC 17025:2017, General requirements for the competence of testing and calibration laboratories
5. ISO 15189:2012, Medical laboratories - Requirements for quality and competence
6. World Health Organization (WHO), External quality assessment, module 10. http://www.who.int/ihr/training/laboratory_quality/10_b_eqa_contents.pdf
7. Hoeltge GA, Duckworth JK. (1987). Review of proficiency testing performance of laboratory accredited by the College of American Pathologists. Arch Pathol Lab Med, 111, 1011-4.
8. Jenny RW, Jackson KY. (1993) Proficiency test performance as a predictor of accuracy of routine patient testing for theophylline. Clin Chem, 39, 76-81.
9. Miller WG. (2008) The role of proficiency testing in achieving standardization and harmonization between laboratories. Clin Biochem, 42, 232-8.
10. Miller WG. (2003). Specimen materials, target values and commutability for external quality assessment (proficiency testing) schemes. Clin Chim Acta, 327, 25-37.
11. Miller WG, Myers GL, Rej R. (2006). Why commutability matters. Clin Chem, 52, 553-4.
12. Bock JL, Endres DB, Elin RJ, Wang E, Rosenzweig B, Klee GG. (2005). Comparison of fresh frozen serum to traditional proficiency testing material in a College of American Pathologists survey for ferritin, folate, and vitamin B12. Arch Pathol Lab Med, 129, 323-7.
13. Schreiber We, Endres DB, MCDowell GA, Palomacki GE, Elin RJ, Klee GG. (2005). Comparison of fresh frozen serum to proficiency testing material in College of American Pathologists surveys: a-fetoprotein, carcinoembryonic antigen, human chorionic gonadotropin, and prostate-specific antigen. Arch Pathol Lab Med, 129, 331-7.
14. Thienpont LM, Stöckl D, Friedecky B, Kratochvila J, Budina M. (2003). Trueness verification in European external quality assessment schemes: time to care about the quality of the samples. Scand J Clin Lab Invest, 63, 195-202.
15. Baadenhuijsen H, Kuypers A, Weykamp K, Cobbaert C, Jansen R. (2005). External Quality Assessment in The Netherlands: time to introduce commutable survey specimens. Lessons from the Dutch “Calibration 2000” project. Clin Chem Lab Med, 43, 304-7.
16. Sciacovelli L, Zardo L, Secchiero S, Plebani M. (2004). Quality specifications in EQA schemes: from theory to practice. Clin Chim Acta, 346, 87-97.
17. Petersen HP, Fraser CG, Kallner A, Kenny D. (1999). Strategies to set gobal analytical quality specifications in laboratory medicine. Scand J Clin Lab Invest, 59, 475-585.
18. Bais R. (2007). EQA from an Australian perspective. Clin Biochem, 28, 175-8.
19. Sciacovelli L, Secchiero S, Zardo L, Zaninotto M, Plebani M. (2006). External quality assessment: an effective tool for clinical governance in laboratory medicine. Clin Chem Lab Med, 44, 740-9.
20. Sciacovelli L, Zardo L, Secchiero S, Zaninotto M, Plebani M. (2003). Interpretative comments and reference ranges in EQA programs as a tool for improving laboratory appropriateness and effectiveness. Clin Chim Acta, 333, 209-19.
21. Belk WP, Sunderman FW. (1947). A survey of the accuracy of chemical analyses in clinical laboratories. Am J Clin Pathol, 17, 853-61.
22. Plebani M, Sanzari MC, Zardo L. (2008). Quality control in coagulation testing. Semin Thromb Hemost, 34, 642-6.
23. Delost MD, Miller WG, Chang GA, Korzun W, Nadder TS. (2009). Influence of credentials of clinical laboratory professionals on proficiency testing performance. Am J Clin Pathol, 132, 550-4.
24. Panteghini M. (2010). Application of traceability concepts to analytical quality control may reconcile total error with uncertainty of measurement. Clin Chem Lab Med, 48, 7-10.
25. Sciacovelli L, Secchiero S, Zardo L, D’Osualdo A, Plebani M. (2007). Risk management in laboratory medicine: quality assurance programs and professionals competence. Clin Chem Lab Med, 45, 756-65.


