
Tác giả: Nguyễn Thị Tuyết, Đại học Khoa Học Tự Nhiên TP. HCM
Email: tuyetnguyen1108@gmail.com
*Ảnh cover: Điều trị đường huyết bằng tiêm insulin (Nguồn: Viện Y Học Ứng Dụng Việt Nam)
Khi chúng ta đề cập đến tiểu đường, đại đa số mọi người đều cho rằng căn bệnh này chỉ xảy ra ở người lớn. Tuy nhiên, căn bệnh này vẫn có thể xảy ra trên trẻ nhỏ với khả năng phát hiện rất thấp, biểu hiện chậm nhưng gây nguy hiểm lớn đến tính mạng của trẻ. Chính vì thế, nhiều trung tâm, bệnh viện trong và ngoài nước đang quan tâm đến việc nghiên cứu và điều trị căn bệnh này.
*Thuật ngữ Neonatal Diabetes Mellitus (NDM) được dùng để chỉ bệnh tiểu đường sơ sinh trên trẻ nhỏ trên các công bố bằng tiếng Anh. Tại Việt Nam, thuật ngữ này được dịch thành: tiểu đường sơ sinh hoặc đái tháo đường sơ sinh. Tôi xin phép được sử dụng thuật ngữ tiểu đường sơ sinh (TĐSS) trong bài viết này.
Tiểu đường được chia thành hai nhóm lớn: tiểu đường type 1 và tiểu đường type 2. Tiểu đường type 1 xảy ra do khiếm khuyết trong di truyền dẫn đến các tế bào sản xuất insulin bị giảm. Chính vì thế, tiểu đường type 1 thường khó kiểm soát và phải điều trị insulin suốt đời. Tiểu đường type 2 thường do việc sản xuất insulin hoặc sử dụng insulin của cơ thể bị giảm. Bệnh nhân thuộc nhóm này được điều trị bằng cách điều chỉnh lại lối sống và chế độ dinh dưỡng hằng ngày.
Tiểu đường sơ sinh (TĐSS) được định nghĩa là tình trạng glucose trong máu trẻ sơ sinh tăng cao trong 6 tháng đầu sau khi sinh do việc sản xuất hoặc sử dụng insulin của cơ thể bị giảm sút (1). Với các triệu chứng không điển hình như tiểu nhiều, bú nhiều, uống nước nhiều, giảm cân nên bệnh thường được chuẩn đoán nhầm với các bệnh về hô hấp và tiêu hóa. Bệnh chỉ được phát hiện khi bệnh nhi có dấu hiệu nhiễm toan (tình trạng lượng acid trong máu và trong mô tăng cao) (2). Nếu không điều trị kịp thời, bệnh nhi sẽ mang những di chứng nặng nề về thần kinh, thậm chí là tử vong.
TĐSS là bệnh di truyền hiếm gặp (thuộc tiểu đường type 1) với tỷ lệ mắc bệnh 1/300.000 – 1/400.000 (2). TĐSS lần đầu tiên được mô tả bởi Kitsell vào năm 1852 trên con trai đã mất của mình (3). Đến năm 1962, Hutchison đã mô tả được tiểu đường sơ sinh tạm thời (Transient Neonatal Diabetes Mellitus) và tiểu đường sơ sinh vĩnh viễn (Permanent Neonatal Diabetes Mellitus (3).
Bất Thường Di Truyền Và Cơ Chế Bệnh Sinh
Tiểu đường sơ sinh tạm thời
Các đột biến gây nên TĐSS tạm thời thường do sự bất thường trong việc methyl hóa DNA trên các đảo CpG. Trong đó, các đột biến trên nhiễm sắc thể số 6 dẫn đến sự hoạt động quá mức của các gen HYMAI (Hydatidiform Mole-Associated And Imprinted Transcript), PLAGL1 (Pleomorphic Adenoma Gene – Like 1), ZFP57 (Zinc Finger Protein 57 Homolog) chiếm tỷ lệ 90% (4). Các gen này đều là những gen đặc trưng cho dấu ấn di truyền thông qua sự khác biệt methyl hóa giữa 2 allele bố và mẹ. Sự bất thường trong HYMAI/PLAGL1 dẫn đến việc methyl hóa quá mức sẽ làm cho tế bào β khởi sự quá trình chết theo chu trình tế bào (apoptosis) (5). Ngược lại, đột biến trên ZFP57 sẽ làm giảm quá trình methyl hóa dẫn đến ức chế quá trình phiên mã, làm các tế bào β suy giảm chức năng (5).
Tiểu đường sơ sinh vĩnh viễn
TĐSS vĩnh viễn là tình trạng tăng glucose trong máu trong 6 tháng sau khi sinh và kéo dài suốt đời. Sự đột biến gen gây nên TĐSS vĩnh viễn thường do sự sai hỏng chức năng của một số protein có chức năng chính trong quá trình sản xuất hoặc vận chuyển insulin như: KCNJ11(30%), ABCC8 (20%), INS (20%) (1)(6).
Đột Biến Trên Gen KCNJ11 (Potassium Channel, Subfamily J, Member 11) Và ABCC8 (ATP-Binding Cassette, Subfamily C, Member 8)
Quá trình tiết insulin được điều hòa bởi các kênh vận chuyển ion xuyên màng trên tế bào β ở đảo tụy. Kênh KATP vận chuyển Kali là một phức hợp gồm 4 tiểu đơn vị Kir6.2 do gen KCNJ11 mã hóa và 4 tiểu đơn vị SUR1 do ABCC8 mã hóa (6). Các tiểu đơn vị Kir6.2 nhạy cảm với Kali- tạo thành cấu trúc lỗ trong - được 4 tiểu đơn vị SUR1 nhạy cảm với sulfonylurea bao quanh bên ngoài.
Ở trạng thái bình thường, kênh KATP sẽ điều hòa quá trình vận chuyển Kali ra khỏi tế bào do tỷ lệ ATP/ADP thay đổi khi glucose được vận chuyển vào trong tế bào. Quá trình vận chuyển Kali ra khỏi tế bào sẽ làm màng tế bào khử cực giúp cho các hạt insulin trong các bóng nội bào được phóng thích (Hình 1).
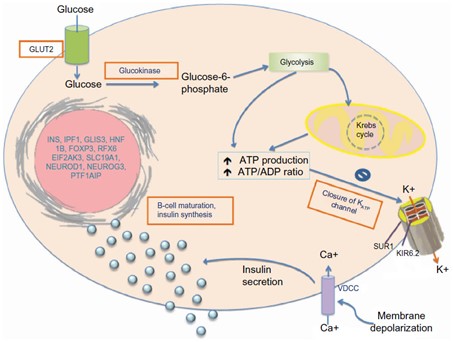
Hình 1: Hoạt động của kênh KATP ở tế bào β đảo tụy. Glucose được vận chuyển vào trong tế bào nhờ kênh vận chuyển GLUT-2 và được phosphoryl hóa thành glucose 6 phosphate (G-6-P) bởi glucokinase. Quá trình này sẽ làm tăng tỷ lệ ATP/ADP và kích thích việc đóng kênh KATP làm cho Kali bị giữ trong tế bào dẫn đến quá trình khử cực màng tế bào. Màng tế bào bị khử cực sẽ làm cho kênh canxi mở ra, canxi tràn vào bên trong và kích thích việc tiết insulin (6).
Khi đột biến xảy ra trên KCNJ11/ ABCC8, các tiểu đơn vị Kir6.2/SUR1 hoạt động bất thường và luôn duy trì trạng thái mở, kali sẽ đi ra khỏi tế bào nhiều. Hệ quả là màng tế bào luôn duy trì quá trình phân cực, điện thế màng ổn định và các hạt insulin không được tiết ra (2)(6).
Đột biến trên gen INS (INSULIN)
Gen INS mã hóa cho một chuỗi protein tiền insulin (proinsulin) gồm 3 chuỗi peptid B, C và A trong tế bào β ở đảo tụy. Các insulin trưởng thành phải trải qua quá trình biến đổi tiền insulin bằng cách cắt chuỗi C và ghép nối chuỗi A và B bằng cầu nối disulfua. Các đột biến trên INS sẽ gây nên các bất thường trong các chuỗi protein tiền insulin và làm cho quá trình cắt nối không thể diễn ra (8). Sự tích lũy các insulin không trưởng thành sẽ bị giữ lại trong lưới nội bào và gây độc cho tế bào.
Các đột biến gây nên bất thường trên tiền insulin thường làm cho quá trình cắt chuỗi C ra khỏi tiền insulin bị gián đoạn làm cho hai chuỗi A và B không thể nối lại với nhau (9). Hoặc, chuỗi C có thể được cắt ra khỏi tiền insulin nhưng sự đột biến trên chuỗi A hoặc B sẽ làm cho việc hình thành cầu nối disulfua không diễn ra được (Hình 2) (8).
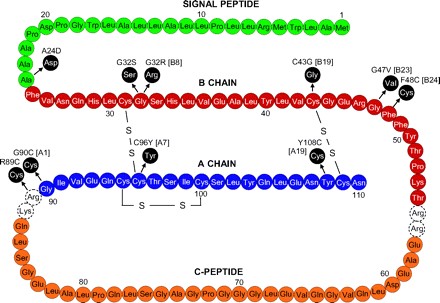
Hình 2: Cấu trúc của tiền insulin và vị trí các đột biến gây nên bất thường trên tiền insulin (7). Đột biến Arg89Cys (thay thế Arg thành Cys tại vị trí acid amin thứ 89) và Gly90Cys (thay thế Gly thành Cys tại vị trí acid amin thứ 90) làm cho đoạn peptid C không thể cắt ra khỏi đoạn peptid A. Đột biến Cys43Gly (thay thế Cys thành Gly tại vị trí acid amin thứ 43) và Cys96Tyr (thay thế Cys thành Tyr tại vị trí acid amin 96) làm cho cầu nối disulfua không thể hình thành.
Điều Trị Tiểu Đường Sơ Sinh Vĩnh Viễn Bằng Insulin Và Sulfonylureas
Việc điều trị TĐSS thường thất bại do sự phức tạp của các đột biến. Hiện nay, chẩn đoán phân tử là một trong những chiến lược điều trị được xem là hiệu quả. Việc giải trình tự gen để xác định các đột biến dẫn đến bệnh sẽ giúp cho các bác sĩ đưa ra những chiến lược điều trị hiệu quả hơn. Trong các kết quả nghiên cứu và điều trị TĐSS vĩnh viễn trên thế giới, việc điều trị bằng insulin và sulnonylurea đã đạt được nhiều kết quả khả quan đối với các bệnh nhi mang đột biến trên INS, ABCC8/KCNJ11 hoặc cả hai. Năm 2006, các nhà nghiên cứu Anh thuộc trường y Peninsula đã điều trị cho 44 bệnh nhi TĐSS (90%) bằng sulfonylureas dựa trên kết quả giải trình tự gen và phát hiện các đột biến trên KCNJ11. Kết quả điều trị cho thấy có sự cải thiện các chỉ số đường huyết và gia tăng việc tiết inslin.
Tại Việt Nam, các công trình nghiên cứu TĐSS của Đại Học Y Dược Hà Nội đã gây được nhiều sự chú ý. Vào năm 2012, tác giả Cấn Thị Bích Ngọc đã báo cáo kết quả điều trị thành công bệnh tiểu đường cho một bệnh nhi mang đột biến KCNJ11 bằng cách thay insulin bằng glibenclamide (10). Đến năm 2014, nhóm tác giả này tiếp tục báo cáo kết quả điều trị thành công bằng việc sử dụng sulfonylureas trên bệnh nhi mang đột biến ABCC8 (11). Ngoài các kết quả trên, nhóm tác giả còn đạt được nhiều nghiên cứu quan trọng trong việc xác định và xây dựng bản đồ gen trên bệnh TĐSS.
Hiên nay, vấn đề nhận thức về tiểu đường sơ sinh vẫn còn rất hạn chế không chỉ ở Việt Nam mà còn trên thế giới do tính chất hiến gặp và khó phát hiện. Chính vì điều này, tỷ lệ biến chứng hoặc tử vong của các bệnh nhi TĐSS thường cao. Vì thế, việc nâng cao ý thức của mọi người về căn bệnh này rất cần thiết. Bên cạnh đó, các nghiên cứu về bệnh TĐSS ở mức độ phân tử, kiểu gen, kiểu hình cũng đang được quan tâm nghiên cứu ở các trung tâm lớn và các bệnh viện. Các kết quả nghiên cứu về di truyền và sinh học phân tử ở TĐSS đóng vai trò quan trọng việc trong : (i) nâng cao tỷ lệ sống sót của bệnh nhi, (ii) tầm soát trước sinh và tư vấn di truyền, (iii) xây dựng được bản đồ gen TĐSS đặc trưng cho từng quốc gia, dân tộc.
Tài liệu tham khảo:
1. Lydia Aguilar-Bryan, Joseph Bryan, "Neonatal Diabetes Mellitus " Endocrine Society, vol. 29, no. 3, p. 265–291, 2008 May.
2. Siri Atma W. Greeley, Susan E. Tucker,Rochelle N. Naylor,Graeme I. Bell, Louis H. Philipson, "Neonatal Diabetes Mellitus: A Model for Personalized Medicine" Trends Endocrinol Metab, vol. 21, no. 8, pp. 464-472, 2011 Aug 1.
3. James H. Hutchison, A. J. Keay, and Margaret M. Kerr, "Congenital temporary diabetes mellitus" Haemolytic Mechanism, pp. 426 - 440, 1692.
4. Siri Atma W. Greeley, Susan E. Tucker, Rochelle N. Naylor, Graeme I. Bell, Louis H. Philipson, "Neonatal diabetes mellitus: A Model for Personalized Medicine," Cell Press, p. 9, 2010.
5. Rochelle N Naylor, Siri Atma W Greeley, Graeme I Bell, Louis H Philipson, "Genetics and pathophysiology of neonatal diabetes mellitus" Journal of Diabetes Investigation, vol. 2, no. 3, p. 158–169, 2011 Jun 5.
6. Sarah E. Flanagan, Vũ Chí Dũng, Jayne A. L. Houghton, Elisa De Franco, Can Thi Bich Ngoc, "An ABCC8 Nonsense Mutation Causing Neonatal Diabetes Through Altered Transcript Expression" J Clin Res Pediatr Endocrinol, vol. 3, no. 9, pp. 260-264, 2017.
7. Dupont J, Pereira C, Medeira A, Duarte R, Ellard S, Sampaio L., "Permanent neonatal diabetes mellitus due to KCNJ11 mutation in a Portuguese family: transition from insulin to oral sulfonylureas." J Pediatr Endocrinol Metab, vol. 25, no. 3, pp. 367-70, 2012.
8. Julie Støy, Emma L. Edghill, Sarah E. Flanagan, Honggang Ye, Veronica P. Paz, Anna Pluzhnikov, Jennifer E. Below, M. Geoffrey Hayes, Nancy J. Cox, Gregory M. Lipkind, Rebecca B. Lipton, Siri Atma W. Greeley, Ann-Marie Patch, Sian Ellard, Donald F. Steiner, "Insulin gene mutations as a cause of permanent neonatal diabetes" PNAS, vol. 104, no. 38, pp. 15040-15044, September 18, 2007.
9. Emma L. Edghill,Sarah E. Flanagan, Ann-Marie Patch, Chris Boustred, Andrew Parrish, Beverley Shields, "Mutations in the INS Gene Are a Common Cause of Neonatal Diabetes but a Rare Cause of Diabetes Diagnosed" Diabetes, vol. 57, pp. 1034-, April, 2008.
10. Cấn Thị Bích Ngọc, Vũ Chí Dũng, Nguyễn Thị Hoàn, Bùi Phương Thảo, Nguyễn Ngọc Khánh, "Nhân một trường hợp đái đường do đột biến gen Kir6.2 điều trị thành công với glibenclamide thay thế cho insulin" Tạp chí Y học Việt Nam, vol. 397, pp. 405 - 411, 2012.
11. Cấn Thị Bích Ngọc, Vũ Chí Dũng, Nguyễn Thị Hoàn, Bùi Phương Thảo, Nguyễn Ngọc Khánh, " Kết quả điều trị bệnh nhân đái tháo đường sơ sinh do đột biến gen KCNJ11 và ABCC8 bằng sulfonylureas" Tạp chí Nghiên cứu Y học, vol. 89, no. 4, pp. 22-31, 2014.
12. I. K. Temple, "Diabetes Mellitus, 6q24-Related Transient Neonatal" Gene Reviews, 2015.


