Một số phương pháp hóa trị liệu ngăn chặn sự tiến triển của ung thư bằng cách đưa tế bào ung thư sang trạng thái dừng phân chia được gọi tên là trạng thái lão hóa. Điều này có nghĩa là những tế bào này có khả năng thúc đẩy sự phát triển khối u nếu thoát khỏi trạng thái lão hóa.
Nếu tế bào gặp một số stress, chúng có thể rơi vào trạng thái dừng phân chia được gọi là lão hóa 1, điều mà được nghĩ đến là có khả năng đảo ngược. Lão hóa bảo vệ sinh vật khỏi quá trình tăng sinh tế bào nguy hiểm, ví dụ bằng cách ngăn chặn tế bào phân chia sau những tổn thương trên DNA. Nhiều liệu pháp chống ung thư gây ra lão hóa tế bào ung thư, đây được xem như một kết quả tích cực của việc điều trị. Tuy nhiên, trên ấn phẩm online của tạp chí Nature, Milanovic và cộng sự2, đã tiết lộ rằng những thay đổi đột ngột mà lão hóa do hóa trị liệu gây ra có thể tạo ra các tế bào khối u. Điều này có tiềm năng thúc đẩy sự phát triển khối u nếu chúng thoát khỏi trạng thái lão hóa.
Sự cảm ứng lão hóa đã được nghiên cứu kỹ lưỡng trong trong nhiều thập kỷ. Hiện tượng này được mô tả lần đầu trên nguyên bào sợi trong in vitro, và việc rơi vào trạng thái lão hóa trong nghiên cứu này được xem xét là một dấu hiệu của lão hóa tế bào 3. Nghiên cứu tiếp theo đã hé lộ về sự cảm ứng lão hóa là đáp ứng tế bào xảy ra trong suốt giai đoạn sinh lý và bệnh lý 1.
Protein p53 là một trong số những protein quan trọng có thể hoạt động như một cảm biến tế bào và đưa tế bào bước vào giai đoạn lão hóa. Nó phản ứng đối với sự phá hủy DNA, và hoạt động này có thể dẫn đến chấm dứt chu kỳ tế bào bằng cách hoạt hóa protein p16INK4a và p21. Giai đoạn lão hóa cũng có thể được thúc đẩy bằng cách thêm nhóm methyl vào các amino acid trên protein histone mà kết hợp với DNA 4. Kết quả của quá trình methyl hóa trong sự nén chặt nhiễm sắc thể sẽ giữ DNA ở trạng thái bất hoạt và giúp chúng đi vào trạng thái lão hóa không thể đảo ngược. Trước đây người ta đã quan sát thấy con đường truyền tín hiệu tế bào hoạt hóa trong suốt quá trình lão hóa cảm ứng hóa trị liệu diễn ra tương tự như sự biểu hiện của các gen kiểu mẫu được ở tế bào gốc, gen kiểu mẫu định nghĩa là gen biểu hiện ở giai đoạn tế bào được gọi là tính “gốc”.
Tế bào gốc nằm ở đỉnh của cây phân cấp tế bào và được biết có khả năng tự phân chia hoặc biệt hóa thành tế bào ở các mô6. Hơn thế nữa, tế bào gốc có thể được tìm thấy trong khối u và những kết quả thực nghiệm chỉ ra tế bào gốc ung thư có thể dẫn đế sự phát triển ung thư, cũng như định hướng sự di cư tế bào khối u và di chuyển đến những khu vực khác trong cơ thể trong quá trình gọi là metastasis 4.
Có một sự đối lập rằng sự cảm ứng lão hóa trong tế bào ung thư dừng sự phát triển khối u sẽ dẫn đến chương trình biểu hiện gen liên quan đến tế bào gốc điều mà dẫn đến bệnh tật. Tuy nhiên các tác giả đã tiến hành quan sát một cách chắc chắn khi họ điều tra trên nhiều loại mô hình ung thư khác nhau ở cả người và chuột.
Để phát hiện liệu rằng những tính “gốc” ảnh hưởng đến sự phát triên khi tế bào ung thư thoát tình trạng lão hóa. Milanovic và cộng sự đã sử dụng khối u biến đổi gen ở chuột ở trạng thái dừng chu kỳ phân chia, trạng thái này có thể được duy trì bằng cách kiểm soát sử dụng thuốc tamoxifen (Hình 1). Đáng ngạc nhiên là các tác giả đã quan sát thấy rằng các tế bào thoát khỏi lão hóa khi tamoxifen được loại bỏ có khả năng tăng cường khối u lớn hơn so với việc kiểm soát các tế bào khối u mà không trải qua một giai đoạn lão hoá. Vì vậy các tác giả kết luận rằng cảm ứng lão hóa trong ung thư có thể có một “mặt tối” ngoài mong muốn nếu tế bào khối u thoát khỏi hàng rào bảo vệ chu kỳ tế bào.
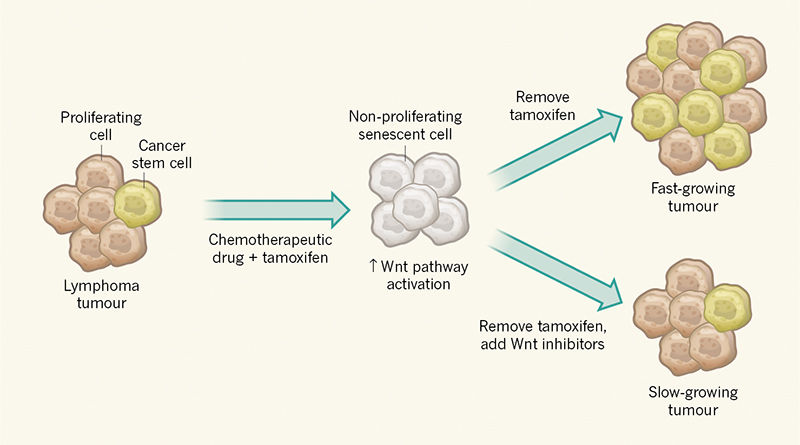
Hình 1. Cảm ứng sự phát triển khối u khi tế bào ung thư thoát khoải quá trình lão hóa. Milanovic và cộng sự2 nghiên cứu sự phát triển khối u ở chuột bằng cách sử dụng khối u bạch cầu biến đổi gene. Những khối u này chứa các tế bào tăng sinh không kiểm soát và một tỉ lệ thấp tế bào gốc ung thư. Trong mô hình này, điều trị hóa trị liệu thúc đẩy tế bào khối u đi vào trạng thái ngừng tăng sinh được gọi là lão hóa (và khi bổ sung thuốc tamoxifen điều hòa hoạt động của protein cần cho giai đoạn lão hóa). Các tác giả nhận thấy rằng quá trình lão hóa liên quan đến sự hoạt hóa con đường tín hiệu Wnt. Loại bỏ tamoxifen có thể làm các tế bào ung thư rời khỏi trạng thái lão hóa. Những tế bào khối u lão hóa xâm lấn có tỷ lệ tế bào gốc ung thư cao và phát triển nhanh hơn so với các tế bào khối u trước khi điều trị hóa trị liệu. Nếu sự loại bỏ tamoxifen được kết hợp với việc bổ sung chất ức chế Wnt, thoát khỏi trạng thái lão hóa mà không liên quan đến những khối u phát triển mạnh hoặc sự hiện diện tỷ lệ cao tế bào gốc ung thư.
Đây không phải là chỉ dẫn đầu tiên cho thấy lão hóa là một cái giá mà tế bào phải trải qua. Ví dụ, tế bào lão hóa tiết ra nhiều loại protein cytokine khác nhau có thể ảnh hưởng đến sự thúc đẩy khối u ở tế bào ung thư bằng cách tăng các đặc tính của tế bào gốc 7, 8. Tuy nhiên các nghiên cứu của Milanovic và đồng nghiệp đã vượt qua các quan sát của một hiệu ứng gián tiếp bằng cách hé lộ rằng các khối u lão hóa có khả năng nội tại để định hình một tỷ lệ gia tăng tế bào gốc ung thư. Mặc dù một vai trò của quá trình này là do cytokines được sản xuất bởi các tế bào xung quanh không bị loại trừ, phân tích của các tác giả trên các tế bào đơn cho thấy có sự liên quan chặc chẽ đến hiện tượng tự trị tế bào “autonomous”. Nghiên cứu này đã hé lộ tê bào ung thư có dấu hiệu lão hóa có thể thoát khỏi quá trình này, tăng sinh và biểu hiện đặc tính của tế bào gốc ung thư. Những đặc điểm của tế bào gốc ung thư có được trong giai đoạn lão hóa trước đó không thể giải thích được do những tế bào này là một phân tử tế bào ung thư đã thất bại khi bước vào giai đoạn lão hóa, bởi vì các tác giả chỉ ra rằng để đi vào giai đoạn lão hóa là một sự yêu cầu cho quá trình này diễn ra.
Các tác giả nhận thấy một mối liên kết giữa sự hoạt hóa chuỗi tín hiệu Wnt và trạng thái lão hóa. Quan sát thấy rằng con đường truyền tín hiệu ở tế bào gốc được hoạt hóa trong suốt quá trình lão hóa cung cấp thêm sự khẳng định và mối liên hệ với sự hình thành các đặc tính của tế bào gốc. Tuy nhiên, tại sao con đường tín hiệu này được hoạt hóa chưa được biết rõ. Cũng như liệu rằng các phối tử Wnt được tiết ra bởi các tế bào lão hóa và liệu rằng những phối tử này sau đó hoạt động trên cùn tế bào mà tiết ra các protein hay trên những tế bào lân cận.
Một cách đáng chú ý, nhận định này cũng đưa ra một ý nghĩa về ảnh hưởng nguy hại tiềm tàng của tế bào gốc ung thư tạo ra. Các tác giả nhận thấy rằng điều trị tế bào với con đường ức chế Wnt có thể giảm sự phát triển khối u khỏi quá trình lão hóa. Khám phá này có thể được phát hiện trong lâm sàng để xác định liệu rằng nghiên cứu trên có thể tăng cường tính hiệu quả của hóa trị liệu.
Mặc dù những nghiên cứu này cung cấp bằng chứng mạnh mẽ về mối liên kết chặt chẽ giữa lão hóa và tính “gốc”, phần lớn nghiên cứu sử dụng mô hình biến đổi gene điều mà cho phép việc thoát khỏi lão hóa được kiểm soát bởi loại bỏ một loại thuốc. Tuy nhiên tế bào ung thư có thể phá hủy một cách tự nhiên hàng rào lão hóa trong in vivo, và phải chăng điều này có thể được liên kết với tính gốc của tế bào ung thư, điều mà nên được tìm hiểu. Các tác giả đã cố gắng để giải quyết vấn đề này trong in vitro, và cũng phát hiện sự tăng lên đặc tính gốc của tế bào ung thư trong trường hợp này. Tuy nhiên những xác nhận bổ sung trên các tế bào ung thư không biến đổi gen là cần thiết. Hơn thế nữa, những số liệu của Milanovic và cộng sự cung cấp những bằng chứng quan trong trong hệ thống mà họ nghiên cứu khi các tế bào ung thư thoát khỏi trạng thái lão hóa, chúng có khả năng định hướng sự phát triển khối u – một phát hiện có ý nghĩa trong lâm sàng.
Nguồn: Nature
Biên dịch: Nguyễn Thị Thu Hoài
Tài liệu tham khảo:
1. Pérez-Mancera, P. A. Young, A. R. & Narita, M. Nature Rev. Cancer 14, 547–558 (2014). DOI: 10.1038/nrc3773
2. Milanovic, M. et al. Nature 553, 96–100 (2018). doi:10.1038/nature25167
3. Hayflick, L. & Moorhead, P. S. Exp. Cell Res. 25, 585–621 (1961). https://doi.org/10.1016/0014-4827(61)90192-6
4. Braig, M. et al. Nature 436, 660–665 (2005). doi:10.1038/nature03841
5. Zon, L. I. Nature 453, 306–313 (2008). DOI: 10.1038/nature07038
6. Medema, J. P. Nature Cell Biol. 15, 338–344 (2013). DOI: 10.1038/ncb2717
7. Mosteiro, L. et al. Science 354, aaf4445 (2016). DOI: 10.1126/science.aaf4445
8. Ritschka, B. et al. Genes Dev. 31, 172–183 (2017). DOI: 10.1101/gad.290635.116


